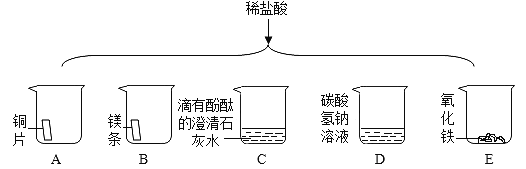
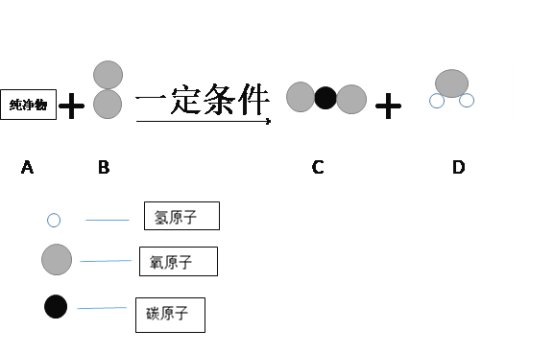
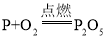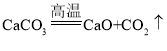题目内容
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线。回答相关问题

(1)t3℃时,甲物质的饱和溶液中,溶质、溶剂、溶液的质量之比为_____。
(2)t2℃时,甲、乙、丙三种物质的饱和溶液中,溶质质量分数的大小关系是_____(用“甲”、“乙”、“丙”及“>”、“<”或“=”表示)
(3)将t3℃的甲、乙、丙三种物质的饱和溶液各100g,分别降温至t1℃,所得溶液的质量最大是_____(用“甲”、“乙”、“丙”填空)。
(4)现有甲、乙混合物溶液,需要从混合物溶液中提纯乙固体,采用的方法有(写出一种即可)_____。
【答案】1:5:6 甲=丙>乙 丙 蒸发结晶
【解析】
(1)从溶解度曲线可知,t3℃时甲物质的溶解度是20g,所以t3℃时甲物质的饱和溶液中,溶质、溶剂、溶液的质量之比=20g∶100g∶120g=1∶5∶6。
(2)从溶解度曲线可知,t2℃时,甲、乙、丙三种物质的溶解度大小关系是:甲=丙>乙,因此t2℃时,甲、乙、丙三种物质的饱和溶液中,溶质质量分数的大小关系是:甲=丙>乙。
(3)将t3℃的甲、乙、丙三种物质的饱和溶液各100g,分别降温至t1℃,因为甲的溶解度减小最大,析出的晶体最多,乙的溶解度减小较小,析出的晶体少于甲,剩余溶液质量乙>甲,而丙溶解度反而增大,没有晶体析出,所以所得溶液的质量最大。故答案为:丙。
(4)现有甲、乙混合物溶液,需要从混合物溶液中提纯乙固体,采用的方法是:蒸发结晶,因为乙的溶解度受温度的影响变化不大;故答案为:蒸发结晶。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
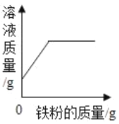
海淀课时新作业金榜卷系列答案【题目】“双吸剂”是常用的袋装食品的保鲜剂,可用来吸收氧气、二氧化碳、水蒸气等气体。某化学小组的同学在袋装食品中发现一包名为“504双吸剂”的保鲜剂,其标签如图所示。同学们对这包久置的“504双吸剂”的固体样品很好奇,涉及实验进行探究。

(提出问题):久置固体的成分是什么?
(收集资料):
(1)查阅资料:铁与氯化铁溶液在常温下生成氯化亚铁:Fe+2FeCl3═3FeCl2
(2)打开固体包装观察:部分粉末呈黑色、部分粉末呈白色、另有少数红棕色的块状固体。
(作出猜想):久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2、CaCO3.你猜想固体中可能含有Fe2O3的依据是_____。
(实验探究):如表是甲组同学涉及并记录的实验报告,请你补充完整。
实验操作 | 实验现象 | 实验结论 |
一、取少量固体加入足量蒸馏水,搅拌溶解 | 固体部分溶解,并放出大量热 | 固体中一定含有_____ |
二、过滤,取滤液滴加无色酚酞试液 | 溶液变红色 | 固体中一定含有氢氧化钙 |
三、取滤渣加入足量稀盐酸 | 固体逐渐消失,产生大量无色气体,得到浅绿色溶液 | 固体中一定含有_____,一定不含有Fe2O3 |
四、将操作三中产生的气体通入到澄清石灰水中 | 澄清石灰水变浑浊 | 固体中一定含有_____ |
(实验质疑):乙组同学认为甲组同学在实验中得出“一定不含有Fe2O3”的结论是错误的,理由是_____;你认为甲组同学哪一步操作得出的结论也不合理___,理由是(用化学方程式表示)_____。
(继续探究):为验证固体中是否含有Fe2O3,乙组同学用___先分离出铁粉,向残留固体中加入足量__,若溶液呈棕黄色,证明固体中含有Fe2O3.写出溶液呈棕黄色的化学反应方程式___。
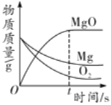
【题目】某校兴趣小组在实验室中完成制取氧气的实验。它们取氯酸钾和二氧化锰的混合物共3.0克放入大试管中加热,并在不同时刻测定试管内剩余固体物质的质量(如下表):
反应时间/min | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
剩余固体质量/g | 2.55 | 2.25 | 2.10 | 2.04 | 2.04 |
分析表中数据,完成下列问题:
(1)完全反应后,生成氧气多少克。
(2)原混合物中氯酸钾的质量分数是多少?