题目内容
【题目】某电镀厂排放的污水中含有CuSO4、ZnSO4和FeSO4,为减少水污染及节约成本,回收重要原料硫酸锌和有关金属,设计如图所示流程。请回答:
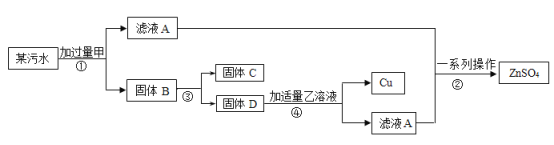
(1)固体B的成分是________;
(2)步骤①④操作相同,该操作是__________;
(3)步骤④中反应的化学方程式是_________。
【答案】锌、铁、铜 过滤 Zn+ H2SO4 =ZnSO4 + H2↑
【解析】
锌、铁、铜的活泼性依次减弱,活泼的金属可以将不活泼的金属置换出来,故甲物质是锌,滤液A是硫酸锌。固体B中含有过量的锌和被置换出来的铁和铜,然后用磁铁将铁吸出,故C是铁,D是锌和铜的混合物。锌可以和稀硫酸反应生成硫酸锌和氢气,而铜不反应,过滤得到铜,故乙物质是稀硫酸。
(1)固体B的成分是锌、铁、铜。
(2)步骤①④都是将固液分离,故是过滤。
(3)步骤④是过量的锌与稀硫酸反应生成硫酸锌和氢气,反应的方程式为:Zn+ H2SO4 =ZnSO4 + H2↑。

练习册系列答案
相关题目
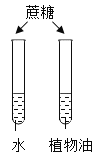
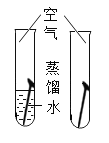
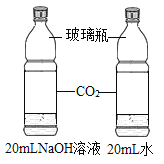
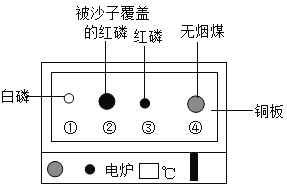
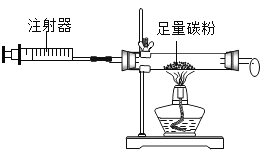
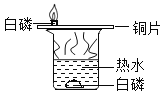
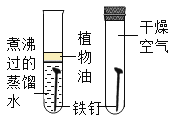
【题目】设计对比实验,控制变量是学习化学的重要方法,下列对比实验不能达到实验目的的是
编号 | A | B | C | D |
实验设计 |
|
|
|
|
实验目的 | 探究同种物质在不同溶剂中的溶解性 | 探究物质燃烧的条件 | 探究铁生锈的条件 | 探究CO2与NaOH溶液能否发生反应 |
A.AB.BC.CD.D