题目内容
【题目】有一包黑色粉末 9.6g,它由氧化铜和木炭粉混合而成。现将它装入大试管中加热到不再生成红色物质为止,冷却后分离,得到红色铜 4.8g,试计算原混合物中氧化铜的质量分数。
【答案】95.3%或 62.5%.
【解析】
该题中碳与氧化铜的反应中得到了铜4.8g,没有说明碳与氧化铜是否完全反应,因此需对反应过程进行讨论,依据铜的质量可计算反应的氧化铜与碳的质量,两者的质量和与原混合物质量进行比较,判断反应的情况,然后对两者反应时的情况进行讨论计算即可。
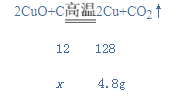
解:由 2CuO+C![]() 2Cu+CO2↑和生成物4.8g 铜,可求出参加反应的CuO和C分别是6g和0.45g,可知必有其中一种反应物尚未完全反应;若CuO过量,设参加反应的C的质量为x,
2Cu+CO2↑和生成物4.8g 铜,可求出参加反应的CuO和C分别是6g和0.45g,可知必有其中一种反应物尚未完全反应;若CuO过量,设参加反应的C的质量为x,
![]()
x=0.45g,
则混合物中氧化铜的质量分数为:![]() ×100%=95.3%;
×100%=95.3%;
若C过量,设参加反应的CuO的质量为y,

![]()
y=6g,
则混合物中氧化铜的质量分数为:![]() ×100%=62.5%;
×100%=62.5%;
答:原混合物中氧化铜的质量分数是:95.3%或62.5%。

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目