题目内容
【题目】课外活动小组为了测定石灰石的纯度,取25g石灰石放入85g稀盐酸的烧杯中,待石灰石完全反应后(杂质不与盐酸反应),烧杯中混合物的质量为101.2 g。求:
(1)生成二氧化碳的质量。
(2)该石灰石中碳酸钙的质量分数。
【答案】(1) 8.8g (2)80%
【解析】石灰石完全反应,即25g石灰石的主要成分碳酸钙全部发生反应,反应中只放出气体二氧化碳,所以反应前后物质总质量会减少,且减少的质量即为二氧化碳气体的质量。
解:(1)、反应中产生CO2的质量为:25+85-101.2=8.8g
(2)、设石灰石中碳酸钙的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
10044
x8.8g![]()
解之得 x=20g
石灰石中碳酸钙质量分数=![]() ×100%=80%
×100%=80%
答:该石灰石中碳酸钙的质量分数为80%

练习册系列答案
相关题目
【题目】现有下图所示的实验装置.
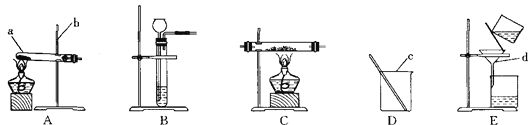
(1)写出图中指定仪器的名称:
a____________;b___________;c___________;d___________.
(2)A装置可用于__________________________(填一个具体实验名称,下同) 的实验.B装置可用于______________________的实验.
(3)现有稀硫酸、CuO和Fe粉三种物质,设计两种制取铜的实验方案,填写下表.
实验方案 | 有关反应的化学方程式 | 选用装置(填字母) |
方案一 | ①________________ ②________________ | ___________ |
方案二 | ①_______________ ②_________________ | ____________ |