题目内容
【题目】含锌废渣和各种锌矿(如菱锌矿)都有着重要的用途以含锌废渣(主要成分为ZnO,杂质为FeO、CuO)为原料制备七水硫酸锌(ZnSO47H2O)的流程如图1.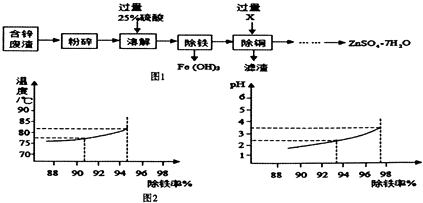
(1)粉碎的目的是 .
(2)若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要的玻璃仪器有胶头滴管、玻璃棒、和 , 此处玻璃棒的作用是 .
(3)物质X是 , 滤渣中含有的金属单质有 , 除铜时发生的反应属于反应(填基本反应类型)
(4)流程中获得七水硫酸锌前省略的操作是、冷却结晶、、洗涤和低温烘干.
(5)某温度下,Fe(OH)3分解得到一种铁、氧质量比21:8的氧化物,该氧化物的化学式 .
(6)除铁过程中,温度、pH对除铁效果的影响分别对如图2所示.由图2可知,除铁时温度应控制在℃为宜,pH应控制在 . 为宜.
【答案】
(1)增大反应物接触面积,加快反应速率
(2)量筒,烧杯,搅拌散热
(3)锌,锌和铜,置换
(4)加热浓缩,过滤
(5)Fe3O4
(6)83,3.5.
【解析】(1)粉碎的目的是增大反应物接触面积,加快反应速率;
(2)若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要的玻璃仪器有胶头滴管、玻璃棒、量筒和烧杯,此处玻璃棒的作用是搅拌散热.
(3)物质X是锌,滤渣中含有的金属单质有反应生成的铜和过量的锌,除铜时锌和硫酸铜反应生成硫酸锌和铜,属于置换反应.
(4)流程中获得七水硫酸锌前省略的操作是加热浓缩、冷却结晶、过滤、洗涤和低温烘干.
(5)设铁的氧化物化学式为FexOy,
根据题意有:56x:16y=21:8,
x:y=3:4,
该氧化物的化学式是Fe3O4.
(6)由图2可知,除铁时温度应控制在83℃为宜,pH应控制在3.5为宜,因为这时除铁率最高.
所以答案是:(1)增大反应物接触面积,加快反应速率;(2)量筒;烧杯;搅拌散热;(3)锌;锌和铜;置换;(4)加热浓缩;过滤;(5)Fe3O4;(6)83;3.5.
【考点精析】根据题目的已知条件,利用金属材料的选择依据和书写化学方程式、文字表达式、电离方程式的相关知识可以得到问题的答案,需要掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属;注意:a、配平 b、条件 c、箭号.

【题目】下列是生活中四种常见物质的近似pH,有关说法正确的是( )
物质 | 陈醋 | 苹果汁 | 牙膏 | 肥皂水 |
pH | 2.5 | 3.1 | 8.5 | 10.0 |
A. 胃酸过多的人在日常饮食中应多食用陈醋
B. 涂抹肥皂水可以缓解蚊虫叮咬后(分泌出酸)的痛痒
C. 牙膏能使紫色石蕊溶液变红
D. 酸性最强的是苹果汁