题目内容
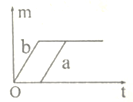
【题目】现有 a、b 两份质量相等的固体,其中 a 为纯净的氯酸钾,b 为氯酸钾和 二氧化锰的混合物,同时加热制氧气.当 a、b 完全反应后,得到的气体与 时间关系正确的是( )
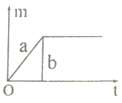
A. 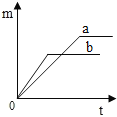 B.
B. 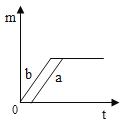
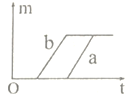
C. 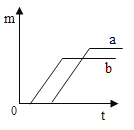 D.
D. 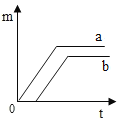
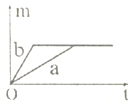
【答案】C
【解析】
因为a、b是两种质量相等的固体,其中a为纯净的氯酸钾,b是氯酸钾和少量二氧化锰的混合物.所以a中氯酸钾的质量大于b中氯酸钾的质量,因而a产生的氧气比b多,b中有催化剂二氧化锰,可以使氯酸钾在较低的温度下迅速的放出氧气,而a却需要在较高的温度下才能缓慢的放出氧气,因而b先得到氧气,a后得到氧气。
A、分析图象可知分析图象可知a产生的氧气多,但却是从一开始就有氧气生成是不正确的,应加热一段时间后再有氧气生成;故A错误;
B、分析图象可知ab反应产生的氧气一样多,故B错误;
C、分析图象可知a产生的氧气多,并是在b产生氧气一段时间后生成,故C正确;
D、分析图象可知a反应从一开始就有氧气产生,比b要先得到氧气,故D错误。
故选C。

【题目】(一)下图所示是一个具有刻度和活塞可滑动的玻璃容器,其中有空气和足量的白磷(白磷的着火点40摄氏度),将它放在盛有沸水的烧杯上方,进行试验。请完成下图所示实验报告。
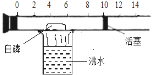
(1)实验目的:______________
(2)实验现象: ①玻璃容器内___________,②活塞_________ ,③活塞最后停在刻度______ 附近
(3)实验结论:空气的成分按体积计算,氧气约占空气体积的五分之一。
(二)学校化学兴趣小组的同学知道二氧化锰能作过氧化氢分解的催化剂以后,想再探究其他一些物质如氧化铝(Al2O3)是否也可作过氧化氢分解的催化剂。请你一起参与他们的探究过程,并填写下列空白:
(1)〔问题〕Al2O3能不能作过氧化氢分解的催化剂呢?
(2)〔猜想〕Al2O3能作过氧化氢分解的催化剂。
(3)〔实验验证〕
实验步骤 | 实验现象 | 实验结论 | |
实验一 | ____________ | 木条不复燃 | 常温下过氧化氢溶液的分解速率很慢 |
实验二 | 在装有过氧化氢溶液的试管中加入少量Al2O3,将带火星的木条伸入试管中 | 木条复燃 | Al2O3能加快过氧化氢的分解速率 |
(4)〔结论〕Al2O3能加快过氧化氢的分解速率,故Al2O3能作过氧化氢分解的催化剂。
(5)〔讨论与反思〕经过讨论,有的同学认为只有上述两个证据,不能证明Al2O3能作过氧化氢分解的催化剂,还要补充一个探究实验(实验三):
〔实验目的〕 探究_________。
〔实验步骤〕 ①准确称量少量Al2O3 的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤、洗涤、烘干、_________;④反应前后进行对比。
〔讨论〕如果Al2O3在反应前后_________不变,_______(“已能”或“还不能”)说明Al2O3可以作过氧化氢分解的催化剂。
理由是:_________