题目内容
过氧化钙晶体(CaO2.8H2O)较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒。以贝壳为原料制备CaO2流程如下:
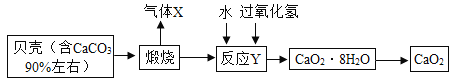
(1)气体X的名称是________;将过氧化钙晶体与溶液分离的方法是________;
(2)反应Y需控制温度在0~5°C,可将反应容器放在________中,该反应是化合反应,反应产物是CaO2?8H2O,请写出化学方程式_____;获得的过氧化钙晶体中常含有Ca( OH)2杂质,原因是______;
(3)过氧化钙晶体(CaO2?8H2O)的相对分子质量为______;H、O元素的质量比为_______;
(4)为测定制得的过氧化钙晶体中CaO2?8H2O的质量分数,设计的实验如下:称取晶体样品50g,加热到220°C充分反应(方程式为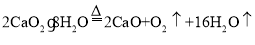 ,杂质不发生变化),测得生成氧气的质量为3.2g,请计算样品中CaO2?8H2O的质量分数,写出必要的计算过程。_______。
,杂质不发生变化),测得生成氧气的质量为3.2g,请计算样品中CaO2?8H2O的质量分数,写出必要的计算过程。_______。
练习册系列答案
相关题目
X、Y、Z、W是四种不同的金属,为比较金属活动性的强弱,某同学利用这四种金属单质、盐酸、Z的硝酸盐、W的硝酸盐,进行有关实验,结果如下表(能发生置换反应的记为“√”,不能反应的记为“一”,无标记的表示未做该实验)。这四种金属的活动性顺序为 ( )
X | Y | Z | W | |
盐酸 | √ | — | — | √ |
Z的硝酸盐 | √ | |||
W的硝酸盐 | √ | — |
A.X>W>Y>Z B.X>Y>W>Z C.W>X>Y>Z D.Y>W>Z>X


