题目内容
【题目】某兴趣小组同学对实验室制取氧气的条件进行如下探究实验。
①为探究催化剂的种类对氯酸钾分解速度的影响,甲设计以下对比实验:
Ⅰ.将4.0g氯酸钾与1.0g二氧化锰均匀混合加热
Ⅱ.将xg氯酸钾与1.0g氧化铁均匀混合加热
在相同温度下,比较两组实验产生氧气的快慢。
Ⅱ中反应的文字表达式是_______________________________;Ⅱ中x的值为___________g。
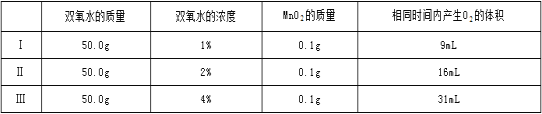
②乙探究了影响双氧水分解速度的某种因素,实验数据记录如表:
实验室通常用两种方法收集氧气,本实验中收集氧气采用的方法利用了氧气______________的性质,能否用另外一种收集方法?______(填“能”或“否”),原因是:________。测量氧气体积的装置是_____(填序号)收集气体前集气瓶内未装满水,对实验结果________(填“有”或“没有”)影响。
实验结论:______________________________________________________,双氧水分解得快。
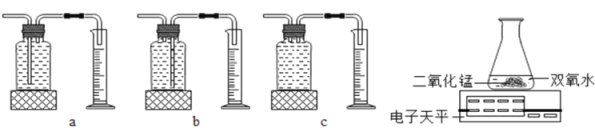
丙用如图装置进行实验,通过比较_________________________________也能达到实验目的。
【答案】氯酸钾![]() 氯化钾+氧气4.0不易溶于水否用向上排空气法收集无法测出相同时间内产生氧气的体积b没有相同条件下,双氧水浓度越大相同时间内电子天平示数变化
氯化钾+氧气4.0不易溶于水否用向上排空气法收集无法测出相同时间内产生氧气的体积b没有相同条件下,双氧水浓度越大相同时间内电子天平示数变化
【解析】
(1)氯酸钾制氧气的文字表达式为:氯酸钾![]() 氯化钾+氧气,实验I和II是一组对比实验,所以氯酸钾的质量应该相同均为4g;
氯化钾+氧气,实验I和II是一组对比实验,所以氯酸钾的质量应该相同均为4g;
(2)本实验通过测定量筒中水的体积 获得氧气的体积。因此只能使用排水集气法,这种方法的依据是氧气不易溶于水。
(3)由表中数据可知,相同条件下,双氧水浓度越大,双氧水的分解越快。依据质量守恒定律,可以测定反应前后反应装置的质量减少的快慢,获得双氧水的分解速率。

 口算题天天练系列答案
口算题天天练系列答案