题目内容
【题目】现有5.6g含有另一种金属的不纯铁块,与足量的稀盐酸反应放出0.18g氢气,则此铁块中可能含有的另一种金属是( )
A.锌 B.镁 C.铜 D.铝
【答案】AC
【解析】通过分析可知,铜不与稀盐酸反应,混入其中会使生成的氢气减少.
假设5.6g全是铁时生成的氢气质量是x.
Fe+H2SO4=FeSO4+H2↑
56 2
5.6g x
则![]() ,解得 x=0.2g.
,解得 x=0.2g.
由以上计算可知,纯铁5.6g与盐酸反应生成的氢气0.2g比实际生成的氢气0.18g多,可推出掺入的金属同质量时生成的氢气要比铁少,或者掺入不与盐酸反应的金属,而6.5克锌会生成0.2克的氢气,2.4克的镁会生成0.2克的氢气,1.8克的铝会生成0.2克的氢气,通过平均值法比较可知,混入的金属可能是锌,不可能是镁、铝.铜不与盐酸反应,故选AC.

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案【题目】研究性学习小组选择“H2O2 生成O2 的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
【假设】H2O2 生成O2的快慢与催化剂种类有关
【实验方案】常温下,在两瓶同质量、同浓度的H2O2 溶液中,分别加入相同质量的MnO2 和水泥块,测量各生成一瓶(相同体积)O2所需的时间.
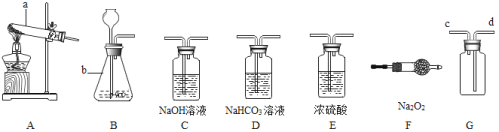
【进行实验】如图是他们进行实验的装置图,气体发生装置中A仪器名称是 ,此实验中B处宜采用的气体收集方法是 .
【实验记录】
实验编号 | 1 | 2 |
反应物 | 5%H2O2 | 5%H2O2 |
催化剂 | 1g水泥块 | 1gMnO2 |
时间 | 165秒 | 46秒 |
【结论】该探究过程得出的结论是 .
【反思】H2O2在常温下分解缓慢,加入MnO2或水泥块后反应明显加快,若要证明MnO2和水泥块是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的 是否改变.
H2O2生成O2的快慢与哪些因素有关?请你帮助他们继续探究.(只要求提出一种影响H2O2生成O2的快慢的因素以及相关假设和实验方案)
【假设】 .
【实验方案】 .