题目内容
某校的探究小组同学想研究氧化铜能否在氯酸钾的受热分解反应中起催化剂的作用,设计了以下的对比实验和操作步骤:
①任取两份氯酸钾,分别放入两支试管,在其中一份中加入经精确称量的n g氧化铜粉末.
②将两份氯酸钾同时在相同的条件下加热,将放出的气体通入水中,观察放出气体的快慢.
③停止加热、冷却,将原先混有氧化铜的反应后的混合物加水溶解,小心过滤,将滤出固体物质洗涤并干燥.
④观察滤出固体物质的状态、颜色.
⑤将滤出固体物质和炭粉混合,在密闭容器中加热,并将反应产生的气体通入澄清石灰水中,并观察实验现象.
(1)从以上有关实验步骤的叙述中可发现操作方案还存在一些缺陷,请指出并加以改进:____________.
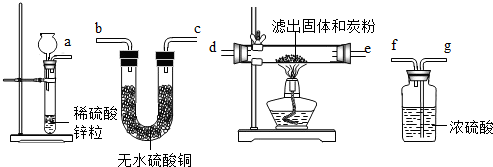
(2)有人换用另一种方法来代替上述第⑤操作,请从如图实验装置中选择仪器中连接成一套实验装置,这套实验装置的连接顺序是______接______、______接______、______接______接______(气流的方向从左往右).

解:(1)做对比实验只能控制一个变量,即有无催化剂,其它因素应都相同;故步骤①不够严密,绝不能“任取两份氯酸钾”,而应“取两份等质量的氯酸钾”;要验证催化剂反应前后质量不变,故因为催化剂的化学性质和质量都保持不变,而步骤⑤只检验了氧化铜的性质是否改变,所以要达到实验目的,第④步中应改为“观察滤出固体物质的状态、颜色,并准确称量干燥后滤出物的质量”.
(2)用H2代替炭粉来还原氧化铜的顺序:锌与硫酸制取氢气→浓硫酸干燥气体→滤出物主要为氧化铜,氢气还原氧化铜→无水硫酸铜验证水分;故这个实验装置的接口连接顺序是a接g; f接d (或e); e(或d)接b(或e)接f.
故答案为:
(1)第①、④两步不严密;第①步中“任取两份氯酸钾”应改为“准确答量两份等质量的氯酸钾”,第④步中应改为“观察滤出固体物质的状态、颜色,并准确称量干燥后滤出物的质量;
(2)a接f; g接d (或e); e(或d)接b(或)接f.
分析:(1)做对比实验只能控制变量唯一,即有无催化剂,其它因素应都应相同.据此,步骤①不够严密,绝不能“任取两份氯酸钾”,而应“取两份等质量的氯酸钾”;根据催化剂的概念,反应后催化剂的性质和质量都保持不变,而步骤⑤只检验了氧化铜的性质是否改变,所以要达到实验目的,第④步中应改为“观察滤出固体物质的状态、颜色,并准确称量干燥后滤出物的质量”.
(3)用H2代替炭粉来还原氧化铜的顺序:锌与硫酸制取氢气→浓硫酸干燥气体→滤出物主要为氧化铜,氢气还原氧化铜→无水硫酸铜验证水分.
点评:了解二氧化锰在此反应中是催化剂的作用,掌握其特点:“一变二不变”;了解仪器的装配或连接;掌握实验室制取氧气的反应原理.
(2)用H2代替炭粉来还原氧化铜的顺序:锌与硫酸制取氢气→浓硫酸干燥气体→滤出物主要为氧化铜,氢气还原氧化铜→无水硫酸铜验证水分;故这个实验装置的接口连接顺序是a接g; f接d (或e); e(或d)接b(或e)接f.
故答案为:
(1)第①、④两步不严密;第①步中“任取两份氯酸钾”应改为“准确答量两份等质量的氯酸钾”,第④步中应改为“观察滤出固体物质的状态、颜色,并准确称量干燥后滤出物的质量;
(2)a接f; g接d (或e); e(或d)接b(或)接f.
分析:(1)做对比实验只能控制变量唯一,即有无催化剂,其它因素应都应相同.据此,步骤①不够严密,绝不能“任取两份氯酸钾”,而应“取两份等质量的氯酸钾”;根据催化剂的概念,反应后催化剂的性质和质量都保持不变,而步骤⑤只检验了氧化铜的性质是否改变,所以要达到实验目的,第④步中应改为“观察滤出固体物质的状态、颜色,并准确称量干燥后滤出物的质量”.
(3)用H2代替炭粉来还原氧化铜的顺序:锌与硫酸制取氢气→浓硫酸干燥气体→滤出物主要为氧化铜,氢气还原氧化铜→无水硫酸铜验证水分.
点评:了解二氧化锰在此反应中是催化剂的作用,掌握其特点:“一变二不变”;了解仪器的装配或连接;掌握实验室制取氧气的反应原理.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目