题目内容
【题目】金属在日常生活中有着广泛的用途:
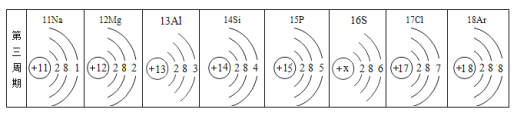
(1)金属元素在自然界中分布很广,地壳中含量最多的金属元素是_____________;
(2)铝制品具有很好的抗腐蚀性能,其原因是______________________(写出反应的化学方程式);
(3)黄铜是铜锌合金,其硬度比纯铜_________(填“大”或“小”);
(4)以下保护金属资源的措施正确的是_________(填字母)。
A.防止金属腐蚀 B.回收利用废旧金属
C.有效合理地开采矿物 D.寻找金属的代用品
(5)请从下列物质中选择药品,设计方案对锌、铁、铜三种金属的活动性顺序进行探究:A.锌片,B.铁钉,C.铜片,D.硫酸铜溶液,E.稀硫酸,F.硫酸锌溶液,G.硫酸亚铁溶液,所选用的三种药品是硫酸锌溶液和________(填字母)。
(6)镁、铝、锌的混合物40g与足量的稀硫酸完全反应,蒸发水后得到136g固体,则反应过程中放出氢气的质量为________g。
【答案】铝 4Al+3O2═2Al2O3 大 ABCD BD 2
【解析】
(1)地壳中含量最多的金属元素是铝;
(2)铝的化学性质比较活泼,能和氧气反应生成一层致密的氧化物薄膜,从而对铝起到保护作用,该反应的化学方程式为:4Al+3O2═2Al2O3;
(3)黄铜是铜锌合金,其硬度比纯铜大;
(4)保护金属资源的措施有:①防止金属腐蚀、②回收利用废旧金属、③有效合理地开采矿物、④寻找金属的代用品,故选ABCD;
(5)根据“三取中”原则,按金属活动顺序将要探究的三种金属整理好,①取活动性位于中间的金属,另外两种取溶液,或②取活动性位于中间的金属的溶液,另外两种取金属。结合题干可知,已经采用了硫酸锌溶液,故另外两种药品是铁和铜的溶液,故选BD;
(6)设参加反应的硫酸的质量为x。
参加反应的硫酸根质量为136g-40g=96g 。
H2SO4里硫酸根的质量分数为![]() ,所以
,所以![]() ×x=96g ,x=98g
×x=96g ,x=98g
所以生成H2为98g-96g=2g。

 阅读快车系列答案
阅读快车系列答案【题目】在高效课堂中,老师和同学们一起对“灭火的原理”进行了探究学习。
(课堂归纳) 通过阅读教材相关内容,我们归纳出燃烧的三个条件是:
①可燃物 ②__________ ③_______
(演示引导)
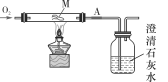
我们进一步学习灭火的原理。如图所示,烧杯中有一支燃着的蜡烛,烧杯底部有一些碳酸钠粉末, 向烧杯中倒入少量稀盐酸,发现蜡烛迅速的熄灭,蜡烛熄灭所依据的原理___。

(小组探究)
点燃一长一短两支蜡烛,同学们分小组对熄灭蜡烛的方法展开探究,并设计了如下实验。
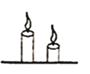
(1)小何说:“因为人呼出的是二氧化碳气体,呼出气体中不含氧气,所以我可以将它们吹灭。” 小邹对小何的说法提出了质疑,认为人呼出的气体中含有氧气,并设计如下实验证明:
实验步骤 | 实验现象 | 实验结论 |
将呼出的气体通过灼热的铜丝 | ________ | ________ |
你认为吹灭蜡烛所依据的灭火原理是___________________________________________。
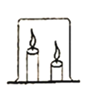
(2)小丽说:“可以在燃着的蜡烛上罩一个大烧杯,过一会儿两根蜡烛也会熄灭。”(如图) 小苗说:“两支蜡烛熄灭是有先后顺序的,因为蜡烛燃烧会产生二氧化碳,二氧化碳的密度比空 气大,所以短蜡烛先熄灭。” 小张说:“由于氧气的密度比空气大,上部氧气少,所以长蜡烛先熄灭。” 同学们一起合作进行了实验,实验发现长蜡烛先熄灭。 小苗对小张的说法仍心存疑惑,认为氧气的密度比空气大不是长蜡烛先熄灭的主要原因,因此她 取短蜡烛一支,长蜡烛一支,分别点燃,罩在同一个大烧杯中,实验发现仍然是长蜡烛先熄灭, 因此小苗发现长蜡烛先熄灭的原因是_________________。
(3)通过探究,小丽进一步提出采用与上述灭火原理不同的方法______________。