题目内容
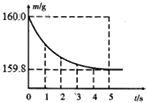
【题目】小李要测定某Cu﹣Zn合金中铜的质量分数,做了如下实验:用100g 的稀硫酸,加入盛有10g合金样品的烧杯中,恰好完全反应,反应过程用精密仪器测得烧杯连同药品的总质量(m)与反应时间(t)的关系如图所示。试计算:
①该合金样品中铜的质量分数;
②反应后所得溶液中硫酸锌的质量分数。(写出解答过程,精确到0.1%)
【答案】35%;15.1%
【解析】反应前后的质量差量是生成氢气的质量:160g-159.8g=0.2g,合金中的锌与稀硫酸反应生成氢气,铜不与稀硫酸反应,设合金中锌的质量为x,生成ZnSO4的质量为y
Zn+ H2SO4 == ZnSO4 + H2↑
65 161 2
x y 0.2g
![]() =
=![]() 解得x=6.5g
解得x=6.5g ![]() =
=![]() 解得y=16.1g
解得y=16.1g
该合金样品中铜的质量分数为: ![]() ×100%=35%
×100%=35%
反应后溶液的质量为:6.5g+100g-0.2g=106.3g
反应后所得溶液中硫酸锌的质量分数为: ![]() ×100%=15.1%
×100%=15.1%

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目