题目内容

探究活动一:泡腾片的发泡原理
【查阅资料】碳酸氢钠(NaHCO3)俗称“小苏打”与酸反应会生成二氧化碳;柠檬酸是一种酸.
【进行实验】按如图装置进行实验:
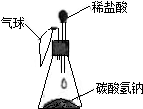
当观察到
【结论】由实验可知:泡腾片放入水中的发泡原理是小苏打与配料中的
探究活动二:NaHCO3和Na2CO3的热稳定性
【提出问题】NaHCO3和Na2CO3与盐酸反应都会生成CO2,那么两者的热稳定性又如何?
【进行猜想】NaHCO3和Na2CO3的热稳定性差,受热都会发生分解反应.
【设计并进行实验】为验证猜想,同学们设计了下图装置并进行实验:
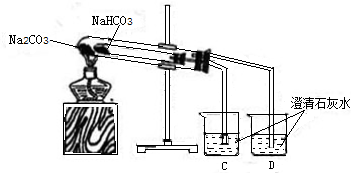
【实验现象】
①装有NaHCO3的小试管内壁有水珠生成.
②烧杯C、D中导管口有气泡冒出,但是有烧杯C中澄清石灰水变浑浊.
③充分加热后,大试管中的固体无明显变化,小试管中仍有少量白色固体残留.
【实验结论】NaHCO3受热会分解,生成水、
【交流与讨论】根据反应物的组成元素,同学们认为残留的白色固体可能是Na2CO3或NaOH中的一种,为检验该白色固体,小强设计了如下方案:
Ⅰ.往残留固体中滴加稀盐酸,观察现象,判断白色固体是否为Na2CO3.
Ⅱ.将残留固体溶于水后,滴加无色酚酞试液,判断白色固体是否为NaOH.同学们经过讨论一致认为方案Ⅱ不行,理由是
小强通过方案Ⅰ的实验得出白色固体是Na2CO3,若让你用另一种试剂来验证Na2CO3,你会选用
【拓展与应用】
①Na2CO3固体混有少量NaHCO3,可采用
A.加盐酸 B.通入CO2 C.加热
②保存该泡腾片应注意
【探究活动二】根据碳酸氢钠的组成及碳酸钠和碳酸氢钠的稳定性和酸的反应进行分析解答;结合碳酸氢钠的性质进行分析解答;书写方程式时要注意条件和配平.
故答案为:产生大量气泡,气球胀大,NaHCO3+HCl=NaCl+H2O+CO2↑.柠檬酸.
【探究活动二】
【实验结论】根据实验现象推断,NaHCO3受热会分解,生成二氧化碳而Na2CO3受热不分解,因此,以上猜想 错误.烧杯C中澄清石灰水变浑浊的反应化学方程式:Ca(OH)2+CO2═CaCO3↓+H2O.
【交流与讨论】Ⅱ:因为碳酸氢钠溶液也是呈碱性的,所以不能根据酚酞变红色来推断一定是氢氧化钠.
根据物质的溶解性可知,鉴别碳酸盐可以用钙离子来检验,所以可以加入氢氧化钙溶液.
【拓展与应用】
①碳酸氢钠受热易分解,故可采用加热的方法除去Na2CO3固体混有少量NaHCO3.
②由于碳酸氢钠不稳定,所以保存时要密闭、放在阴凉处.
故答案为:【实验结论】二氧化碳,错误 Ca(OH)2+CO2═CaCO3↓+H2O.
【交流与讨论】Ⅱ.碳酸钠和氢氧化钠的水溶液都呈碱性,都能使酚酞变红.
Ca(OH)2.
【拓展与应用】
①C
②防潮防晒.

 名校课堂系列答案
名校课堂系列答案(2010?泉州)下表是元素周期表中第三周期的部分元素(氩元素除外),在化学反应中,从左到右原子失电子能力逐渐减弱,得电子能力逐渐增强.
|
(7分)2010年我省部分地区监测到的雨水平均pH如下表。请回答下列问题:
| 城市 | 福州 | 厦门 | 泉州 | 三明 | 漳州 | 龙岩 | 南平 |
| 2008年雨水平均pH | 4.47 | 4.8 | 4.54 | 6.37 | 4.86 | 4.83 | 4.58 |
(1)上表列举的7个地区中,没有酸雨污染的地区是_______;导致酸雨的主要气体是_________(填序号):①CO ②CO2 ③SO2 ④NO2 。
(2)若酸雨的主要成分为H2SO4和HNO3,请写出下列化学方程式:
(a)含H2SO4的酸雨腐蚀七星岩的石灰石 ;
(b)含HNO3的酸雨与撒在田地里的熟石灰反应 。
(3)为了改善福州环境质量、迎接“特奥会”,下列措施不能减少酸雨的是__________(填序号):①推广清洁能源 ②减少用煤直接作燃料 ③淘汰尾气不达标的汽车 ④限制燃放烟花爆竹 ⑤限制并有偿使用塑料袋。
(7分)2010年我省部分地区监测到的雨水平均pH如下表。请回答下列问题:
| 城市 | 福州 | 厦门 | 泉州 | 三明 | 漳州 | 龙岩 | 南平 |
| 2008年雨水平均pH | 4.47 | 4.8 | 4.54 | 6.37 | 4.86 | 4.83 | 4.58 |
(2)若酸雨的主要成分为H2SO4和HNO3,请写出下列化学方程式:
(a)含H2SO4的酸雨腐蚀七星岩的石灰石 ;
(b)含HNO3的酸雨与撒在田地里的熟石灰反应 。
(3)为了改善福州环境质量、迎接“特奥会”,下列措施不能减少酸雨的是__________(填序号):①推广清洁能源 ②减少用煤直接作燃料 ③淘汰尾气不达标的汽车 ④限制燃放烟花爆竹 ⑤限制并有偿使用塑料袋。
(7分)2010年我省部分地区监测到的雨水平均pH如下表。请回答下列问题:
|
城市 |
福州 |
厦门 |
泉州 |
三明 |
漳州 |
龙岩 |
南平 |
|
2008年雨水平均pH |
4.47 |
4.8 |
4.54 |
6.37 |
4.86 |
4.83 |
4.58 |
(1)上表列举的7个地区中,没有酸雨污染的地区是_______;导致酸雨的主要气体是_________(填序号): ①CO ②CO2 ③SO2 ④NO2 。
(2)若酸雨的主要成分为H2SO4和HNO3,请写出下列化学方程式:
(a)含H2SO4的酸雨腐蚀七星岩的石灰石 ;
(b)含HNO3的酸雨与撒在田地里的熟石灰反应 。
(3)为了改善福州环境质量、迎接“特奥会”,下列措施不能减少酸雨的是__________(填序号):①推广清洁能源 ②减少用煤直接作燃料 ③淘汰尾气不达标的汽车 ④限制燃放烟花爆竹 ⑤限制并有偿使用塑料袋。