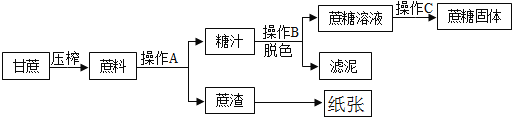
题目内容
【题目】利用以下装置对碱的化学性质进行探究:
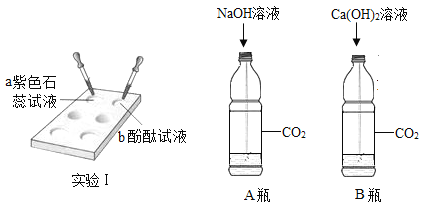
(1)实验I中,在点滴板的a、b穴中滴入碱溶液后,溶液变红的是___(填“a”或“b”)。使用点滴板的优点之一是____。
(2)小云同学向两个充满CO2气体的塑料瓶中分别加入NaOH溶液和Ca(OH)2溶液,迅速盖紧瓶盖后充分振荡,结果发现两个塑料瓶都变瘪。据此实验现象,小云判定NaOH和Ca(OH)2均能与CO2发生反应
①小明同学认为上述判定方法还存在不严密之处,他的理由___。
②小华同学根据B瓶中出现的浑浊现象,判定Ca(OH)2与CO2发生了反应,该反应的化学方程式为____,因此提出了可以从是否有新物质生成的角度去判断。若要判定NaOH和CO2发生了反应,在排除了①中的干扰因素后,接下来的方法是:取A瓶中的溶液少量于试管中,然后滴加____,若观察到____,证明NaOH和CO2发生了反应。
【答案】b 节约药品或方便观察实验现象或现象更明显 二氧化碳能与水反应或二氧化碳能够溶于水 Ca(OH)2+CO2=CaCO3↓+H2O 足量稀盐酸 有气泡生成
【解析】
(1)碱性溶液能使酚酞变红,使石蕊变蓝,实验I中,在点滴板的a、b穴中滴入碱溶液后,溶液变红的是b酚酞试液。使用点滴板可以节约药品,方便观察实验现象或现象更明显。
(2) ①NaOH溶液和Ca(OH)2溶液中都有水,故上述判定方法还存在不严密之处。
②Ca(OH)2与CO2反应生成碳酸钙沉淀和水,反应的方程式为:Ca(OH)2+CO2=CaCO3↓+H2O,在排除了①中的干扰因素后,接下来的方法是:取A瓶中的溶液少量于试管中,然后滴加足量稀盐酸,若观察到有气泡生成,证明NaOH和CO2发生了反应。

【题目】下列归纳总结完全正确的一组是()
A 分子特征 | B 数字含义 |
①水分子很小 ②固体物质的分子不运动 ③气体分子间的间隔很大 | ① ② ③NO2 :1个二氧化氮分子中含有2个原子 |
C 实验安全 | D 常见物质 |
①把鼻孔凑到容器口闻药品 ②不能用手接触药品 ③不能尝任何药品的味道 | ①区分氯酸钾和高锰酸钾:观察颜色 ②区分硬水和软水:加肥皂水后搅拌 ③区分过氧化氢溶液和水:加入MnO2观察现象 |
A.AB.BC.CD.D
【题目】水是生命之源,人类的日常生活离不开水。
(1)对于沉淀、过滤、吸附、蒸馏等净化水的操作,净化程度相对较高的是________。
(2)写出电解水的化学反应方程式:________;该反应的基本类型是________________。
(3)A、B、C三种固体的溶解度曲线如下图所示:
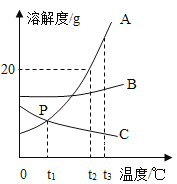
①P点的含义是________;
②t2℃时,将15gA物质加入50g水中,充分溶解后,形成溶液的质量为________g;
③若A物质中含有少量的B物质,提纯A物质的方法是________(填“降温”或“蒸发”)结晶。
(4)下表是![]() 在水中的溶解度的几组数据:(单位:mL)
在水中的溶解度的几组数据:(单位:mL)
温度/t℃ | 0 | 25 | 50 | 75 | 100 |
压强101KPa 1时的溶解度 | 1.79 | 0.752 | 0.423 | 0.307 | 0.231 |
压强101KPa 10时的溶解度 | 15.92 | 7.14 | 4.095 | 2.99 | 2.28 |
压强101KPa 25时的溶解度 | 29.30 | 16.20 | 9.71 | 6.82 | 5.73 |
①根据数据![]() 在水中的溶解度随温度的升高而________(填“增大”或“减小”)。
在水中的溶解度随温度的升高而________(填“增大”或“减小”)。
②打开汽水瓶盖有气体溢出,说明原瓶内的气压________(填“>”“=”或“<”)瓶外大气压。
(5)配制500克溶质质量分数为0.9%的生理盐水,正确的实验操作顺序是________(填序号)
①溶解 ②溶液装瓶、贴标签 ③称量 ④计算 ⑤量取
【题目】某兴趣小组对KClO3分解反应的催化剂进行研究,在相同的加热条件下,用下图装置完成表中实验:
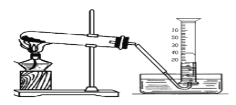
编号 | KClO3质量/g | 催化剂 | 催化剂质量/g | 收集50mLO2所需时间/s |
实验1 | 5 | - | - | 171 |
实验2 | 5 | MnO2 | 0.5 | 49 |
实验3 | 5 | Fe2O3 | 0.5 | 58 |
实验4 | 5 | KCl | 0.5 | 154 |
(1)设置实验1的目的是_____
(2)写出实验3的符号表达式_____
(3)表中所列3种催化剂的催化效果最佳的是_____
(4)由实验1和实验4可知,KCl_____(填“有”或“无”)催化作用。维持加热条件不变,用实验1再继续收集收集50mLO2,所需时间明显少于171s,解释原因:_____