题目内容
【题目】某化学小组参观制碱厂后,绘制了该厂生产纯碱的工艺流程图(如图所示),据图回答:
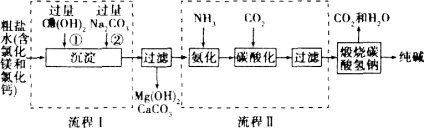
(1)流程Ⅰ是依次向粗盐水中加入Ca(OH)2和Na2CO3,二者加入的顺序能否颠倒?为什么?________________________________________________________________________.
(2)用一个化学反应方程式表示出流程Ⅱ中发生的总反应:________________________________.
(3)如果不将氯化铵作为目标产品,即加入氨气不是为了生产出氯化铵,那么,氨气在制碱过程中的作用是________________________________________________.
(4)工业生产纯碱的流程中,碳酸化时溶液中析出碳酸氢钠而没有析出氯化铵的原因是________________________________________.
【答案】(1)不能颠倒,如果颠倒,过量的氢氧化钙和新生成的氯化钙无法除去
(2)NaCl+H2O+NH3+CO2=NaHCO3↓+NH4Cl
(3)增大二氧化碳的吸收量(或媒介作用等合理答案均可)
(4)在该温度下碳酸氢钠的溶解度比氯化铵小
【解析】(1)加入Ca(OH)2后,发生的反应为Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓,多余的Ca(OH)2以及生成的CaCl2中的Ca2+可以被后加入的Na2CO3除去.
(3)氨气溶于水使溶液呈碱性,有利于二氧化碳的吸收.
(4)工业生产纯碱的流程中,碳酸化时溶液中析出碳酸氢钠而没有析出氯化铵的原因是在该温度下碳酸氢钠的溶解度比氯化铵小.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目