题目内容
(2011?常熟市二模)硫酸铜晶体常用作农业和渔业的杀虫剂、杀菌剂.以下是由废铜料(含铁)生产硫酸铜晶体的流程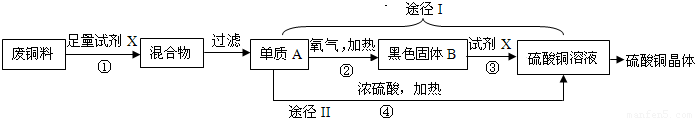
(1)反应①的化学方程式为______.
(2)途径I中,反应②、③的化学方程式分别为②______ 2CuO
【答案】分析:(1)欲制得硫酸铜必须先把铁除去,故反应①为铁盒硫酸的反应;
(2)反应②为金属单质铜与氧气在加热条件下所发生的反应,生成黑色固体氧化铜,两种物质生成一种物质的反应;反应③则应是黑色固体氧化铜与稀硫酸的复分解反应,途径II要生成二氧化硫会污染空气,所以应该选择途径I;
(3)根据质量守恒定律来解答该题;
(4)根据锌的性质,结合浓硫酸随着反应的进行浓度的变化来解答该题.
解答:解:(1)废铜料中含有铁,所以要值得硫酸铜,应该先把铁除去,除去铁应该选用稀硫酸,故可以写出该反应的化学方程式;
(2)反应②为金属单质铜与氧气在加热条件下所发生的反应,生成黑色固体氧化铜,两种物质生成一种物质的反应;反应③则应是黑色固体氧化铜与稀硫酸的复分解反应,途径II要生成二氧化硫会污染空气,所以应该选择途径I;
(3)反应是在浓硫酸中进行的,如果完全反应根据化学方程式可以计算出应该生成3.2g气体,但是随着反应的进行浓硫酸会变稀,而使反应终止,故难以生成3.2g二氧化硫,即实际上生成的气体要小于3.2g;
(4)锌是活泼金属可以和稀硫酸反应生成氢气,所以随着反应的进行浓硫酸的浓度越来越小,故可能生成氢气;
故答案为:(1)Fe+H2SO4═FeSO4+H2↑;
(2)②2Cu+O2═2CuO;③CuO+H2SO4═CuSO4+H2O;Ⅰ;
(3)B;
(4)H2(或氢气);反应一段时间后,硫酸溶液溶质的质量分数变小,锌与稀硫酸反应生成氢气(或反应一段时间后,硫酸溶液溶质的质量分数变小,Zn+H2SO4═ZnSO4+H2↑);
点评:据生产流程图,正确理解每个过程在生产中的作用,从而达到全面掌握生产过程的目的,为解答问题做足准备.
(2)反应②为金属单质铜与氧气在加热条件下所发生的反应,生成黑色固体氧化铜,两种物质生成一种物质的反应;反应③则应是黑色固体氧化铜与稀硫酸的复分解反应,途径II要生成二氧化硫会污染空气,所以应该选择途径I;
(3)根据质量守恒定律来解答该题;
(4)根据锌的性质,结合浓硫酸随着反应的进行浓度的变化来解答该题.
解答:解:(1)废铜料中含有铁,所以要值得硫酸铜,应该先把铁除去,除去铁应该选用稀硫酸,故可以写出该反应的化学方程式;
(2)反应②为金属单质铜与氧气在加热条件下所发生的反应,生成黑色固体氧化铜,两种物质生成一种物质的反应;反应③则应是黑色固体氧化铜与稀硫酸的复分解反应,途径II要生成二氧化硫会污染空气,所以应该选择途径I;
(3)反应是在浓硫酸中进行的,如果完全反应根据化学方程式可以计算出应该生成3.2g气体,但是随着反应的进行浓硫酸会变稀,而使反应终止,故难以生成3.2g二氧化硫,即实际上生成的气体要小于3.2g;
(4)锌是活泼金属可以和稀硫酸反应生成氢气,所以随着反应的进行浓硫酸的浓度越来越小,故可能生成氢气;
故答案为:(1)Fe+H2SO4═FeSO4+H2↑;
(2)②2Cu+O2═2CuO;③CuO+H2SO4═CuSO4+H2O;Ⅰ;
(3)B;
(4)H2(或氢气);反应一段时间后,硫酸溶液溶质的质量分数变小,锌与稀硫酸反应生成氢气(或反应一段时间后,硫酸溶液溶质的质量分数变小,Zn+H2SO4═ZnSO4+H2↑);
点评:据生产流程图,正确理解每个过程在生产中的作用,从而达到全面掌握生产过程的目的,为解答问题做足准备.

练习册系列答案
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目