题目内容
一定质量的5%的氢氧化钠溶液,加热蒸发掉120g水后变成密度为1.01g/cm312.5%的溶液.则原溶液的质量为
200
200
g,剩余溶液的体积为79.2
79.2
mL.(计算结果保留一位小数)分析:设原溶液的质量为x,由题意一定质量的5%的氢氧化钠溶液,加热蒸发掉120g水后变成密度为1.01g/cm312.5%的溶液,据此根据稀释前后,溶质的质量不变,进行分析解答.
解答:解:设原溶液的质量为x,则x×5%=(x-120g)×12.5% x=200g
V=
=
≈79.2mL.
故答案为:200;79.2.
V=
| m |
| ρ |
| 200g-120g |
| 1.01g/cm3 |
故答案为:200;79.2.
点评:本题难度不大,掌握溶质质量分数的有关计算并能灵活运用是正确解答本题的关键.

练习册系列答案
相关题目
(6分)水和溶液在生命活动和生产、生活中起着十分重要的作用。
(1)净水器中经常使用活性炭,主要利用活性炭的_______性。
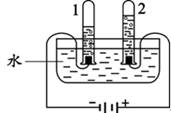
(2)根据图中实验只生成了氢气和氧气,确定水是由氢元素和氧元素组成的,得到此结论的依据是________。写出此实验中发生反应的化学方程式________。
(3)烧杯中盛有一定质量、温度为80℃、溶质为M的溶液,将其置于室温环境中,测定不同温度时析出固体M的质量。测定结果记录如下表。
|
溶液的温度/℃ |
75 |
65 |
50 |
35 |
20 |
|
析出固体M的质量/g |
0 |
0 |
2.0 |
4.5 |
8.4 |
若不考虑水蒸发对实验的影响,请回答下列问题。
① 65℃时,该溶液是否为饱和溶液? (填“是”、“否”或“无法判断”);
② 将t℃时接近饱和的M溶液变成饱和溶液,下列方法中一定能达到目的的是 (填字母序号);
A. 升温 B. 降温 C. 加溶质M
D. 加水 E. 加另一种固体N F. 恒温蒸发水
G. 与t℃时M的饱和溶液混合
③ 20℃时,用固体粉末M和水配制100g溶质质量分数为5%的M溶液,必须用到的仪器有:托盘天平(带砝码)、烧杯、 。
试依据核电荷数为1-18的元素的原子结构示意图,回答下列问题:
(1)现以第三周期为例,回答下列问题
①从原子结构示意图分析,此周期排列的依据是______;
②在此周期中,原子结构变化情况是______;
③在此周期中,元素化学性质的变化情况是______;
④在此周期中,元素种类的变化情况是______.
(2)上图中硫元素的核电荷数z=______;氯元素的最外层电子数Y=______(填数值),则与氯元素化学性质相似的元素是______.
(3)核电荷数为12的元素的原子失去两个电子后,形成的粒子的符号是______,它的核外电子排布与______元素的原子核外电子排布相同.
(4)上图的排列具有一定的规律,如:同一行中,从左到右元素的核电荷数依次增加.你还能找到哪些规律?试写出其中一个:______.
(5)钙元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中.该元素的原子结构示意图如图所示,则该元素的原子序数为______,该元素属于______(填“金属”或“非金属”)元素,该元素在化合物中的常见化合价为______.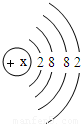 元素在上表中位于______(选A、B、C)处.
元素在上表中位于______(选A、B、C)处.
(6)月球上的3He(3表示相对原子质量)蕴藏量巨大,探月的目标之一是探测核聚变燃料3He的分布.地球上的氦元素主要以4He形式存在.从原子的构成来看,3He、4He两种原子的中子数______(填相同或不同),化学性质______.
 氢(H) 氢(H) |  氦(He) 氦(He) | ||||||
 锂( Li) 锂( Li) |  铍(Be) 铍(Be) |  硼(B) 硼(B) |  碳(C) 碳(C) | 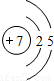 氮(N) 氮(N) |  氧(O) 氧(O) |  氟(F) 氟(F) |  氖(Ne) 氖(Ne) |
 钠(Na) 钠(Na) |  镁(Mg) 镁(Mg) |  铝(Al) 铝(Al) |  硅(Si) 硅(Si) |  磷(P) 磷(P) |  硫(S) 硫(S) |  氯(Cl) 氯(Cl) | 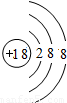 氩(Ar) 氩(Ar) |
| A | B | C | |||||
①从原子结构示意图分析,此周期排列的依据是______;
②在此周期中,原子结构变化情况是______;
③在此周期中,元素化学性质的变化情况是______;
④在此周期中,元素种类的变化情况是______.
(2)上图中硫元素的核电荷数z=______;氯元素的最外层电子数Y=______(填数值),则与氯元素化学性质相似的元素是______.
(3)核电荷数为12的元素的原子失去两个电子后,形成的粒子的符号是______,它的核外电子排布与______元素的原子核外电子排布相同.
(4)上图的排列具有一定的规律,如:同一行中,从左到右元素的核电荷数依次增加.你还能找到哪些规律?试写出其中一个:______.
(5)钙元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中.该元素的原子结构示意图如图所示,则该元素的原子序数为______,该元素属于______(填“金属”或“非金属”)元素,该元素在化合物中的常见化合价为______.
 元素在上表中位于______(选A、B、C)处.
元素在上表中位于______(选A、B、C)处.(6)月球上的3He(3表示相对原子质量)蕴藏量巨大,探月的目标之一是探测核聚变燃料3He的分布.地球上的氦元素主要以4He形式存在.从原子的构成来看,3He、4He两种原子的中子数______(填相同或不同),化学性质______.
 (1)时下有些年轻人喜欢染发,染发时一般要用到一种着色剂--对苯二胺,其化学式为C6H8N2.它是一种有毒的化学药品,会对染发者的身体带来伤害.
(1)时下有些年轻人喜欢染发,染发时一般要用到一种着色剂--对苯二胺,其化学式为C6H8N2.它是一种有毒的化学药品,会对染发者的身体带来伤害.