题目内容
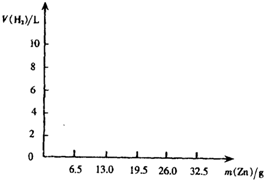 (2002?重庆)用锌与硫酸溶液反应,五次实验结果记录如下:
(2002?重庆)用锌与硫酸溶液反应,五次实验结果记录如下:| 实验序号 | 锌的质量/g | 硫酸溶液的质量/g | 在实验条件下氢气的体积/L |
| l | 6.5 | 200 | 2.30 |
| 2 | 13.0 | 200 | 4.60 |
| 3 | 19.5 | 200 | 6.90 |
| 4 | 26.0 | 200 | 9.20 |
| 5 | 32.5 | 200 | 9.20 |
(1)根据表中数据画出氢气的体积随锌的质量变化的关系图.
(2)求硫酸溶液中H2SO4的质量分数.
(3)根据表中数据简要说明第4次实验中H2SO4和Zn恰好完全反应的理由.
分析:(1)找出横坐标新的质量与纵坐标产生气体的体积对应的点,连线即可;
(2)欲正确解答本题,需根据化学方程式得出各物质之间的质量比,列出比例式,通过计算得出所需物质的质量.然后根据溶质质量分数公式计算即可.
(3)根据完全反应的概念,结合图表信息,就可找出第几次实验中Zn与H2SO4恰好完全反应.
(2)欲正确解答本题,需根据化学方程式得出各物质之间的质量比,列出比例式,通过计算得出所需物质的质量.然后根据溶质质量分数公式计算即可.
(3)根据完全反应的概念,结合图表信息,就可找出第几次实验中Zn与H2SO4恰好完全反应.
解答:解:(1)如右图

(2)解:设与26.0g Zn反应的H2SO4的质量为x.
Zn+H2SO4═ZnSO4+H2↑
65 98
26.0g x
=
x=39.2g
硫酸溶液中H2SO4的质量分数为:
×100%=19.6%
答:硫酸溶液中H2SO4的质量分数为19.6%
(3)第5次实验中氢气的体积与第4次实验中氢气的体积相等,说明第4次实验中 恰好完全反应; 前3次实验中Zn完全反应,第4次实验中Zn的质量与第1(或2、3)次实验中Zn的质量之比等于第4次实验中的体积与第1(或2、3)次实验中的体积之比,说明第4次实验中Zn恰好完全反应.
故答案为:第5次实验中氢气的体积与第4次实验中氢气的体积相等,说明第4次实验中 恰好完全反应; 前3次实验中Zn完全反应,第4次实验中Zn的质量与第1(或2、3)次实验中Zn的质量之比等于第4次实验中的体积与第1(或2、3)次实验中的体积之比,说明第4次实验中Zn恰好完全反应.

(2)解:设与26.0g Zn反应的H2SO4的质量为x.
Zn+H2SO4═ZnSO4+H2↑
65 98
26.0g x
| 65 |
| 26.0g |
| 98 |
| x |
x=39.2g
硫酸溶液中H2SO4的质量分数为:
| 39.2g |
| 200g |
答:硫酸溶液中H2SO4的质量分数为19.6%
(3)第5次实验中氢气的体积与第4次实验中氢气的体积相等,说明第4次实验中 恰好完全反应; 前3次实验中Zn完全反应,第4次实验中Zn的质量与第1(或2、3)次实验中Zn的质量之比等于第4次实验中的体积与第1(或2、3)次实验中的体积之比,说明第4次实验中Zn恰好完全反应.
故答案为:第5次实验中氢气的体积与第4次实验中氢气的体积相等,说明第4次实验中 恰好完全反应; 前3次实验中Zn完全反应,第4次实验中Zn的质量与第1(或2、3)次实验中Zn的质量之比等于第4次实验中的体积与第1(或2、3)次实验中的体积之比,说明第4次实验中Zn恰好完全反应.
点评:本题主要考查学生对完全反应的认识以及运用化学方程式和质量分数公式进行计算的能力.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目