题目内容
(2009?恩施州)现有4g由Cu和另一种金属形成的混合物,将其加入足量的稀盐酸充分反应后得到0.2g氢气,则另一种金属是( )| 选项 | A | B | C | D |
| Ag | Zn | Fe | Mg | |
| 金属活动性顺序 | 强K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au 弱 | |||
【答案】分析:铜不与盐酸反应,得到的0.2g氢气均由另一种金属反应生成,先用极值法求的另一种金属的质量,然后用近似平均值法确定具体是哪一种金属.
解答:解;A、Ag在氢的后面,不能与盐酸反应生成氢气,故A错误;
B、设生成0.2g氢气需要锌的质量为x,则有
Zn+2HCl=ZnCl2+H2↑
65 2
x 0.2g
 =
=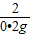
x=6.5g
混合物的质量为4g即可产生0.2g氢气,而需要锌6.5g才能产生0.2g氢气,故B错误;
C、设生成0.2g氢气需要铁的质量为y,则有
Fe+2HCl=FeCl2+H2↑
56 2
y 0.2g
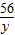 =
=
y=5.6g
混合物的质量为4g即可产生0.2g氢气,而需要铁5.6g才能产生0.2g氢气,故C错误;
D、设生成0.2g氢气需要镁的质量为z,则有
Mg+2HCl=MgCl2+H2↑
24 2
z 0.2g
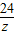 =
=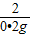
z=2.4g
混合物的质量为4g即可产生0.2g氢气,需要镁的质量为2.4g,则铜为1.6g,故D正确,
故选D.
点评:本题考查了混合金属与酸反应生成氢气的质量关系,完成此题,可以先采用极值法,求出产生氢气所需金属的质量,然后根据近似平均值法确定混合金属的成分.
解答:解;A、Ag在氢的后面,不能与盐酸反应生成氢气,故A错误;
B、设生成0.2g氢气需要锌的质量为x,则有
Zn+2HCl=ZnCl2+H2↑
65 2
x 0.2g
 =
=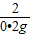
x=6.5g
混合物的质量为4g即可产生0.2g氢气,而需要锌6.5g才能产生0.2g氢气,故B错误;
C、设生成0.2g氢气需要铁的质量为y,则有
Fe+2HCl=FeCl2+H2↑
56 2
y 0.2g
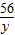 =
=
y=5.6g
混合物的质量为4g即可产生0.2g氢气,而需要铁5.6g才能产生0.2g氢气,故C错误;
D、设生成0.2g氢气需要镁的质量为z,则有
Mg+2HCl=MgCl2+H2↑
24 2
z 0.2g
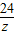 =
=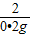
z=2.4g
混合物的质量为4g即可产生0.2g氢气,需要镁的质量为2.4g,则铜为1.6g,故D正确,
故选D.
点评:本题考查了混合金属与酸反应生成氢气的质量关系,完成此题,可以先采用极值法,求出产生氢气所需金属的质量,然后根据近似平均值法确定混合金属的成分.

练习册系列答案
相关题目