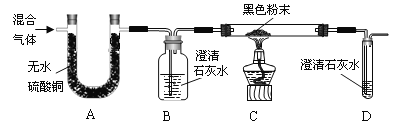
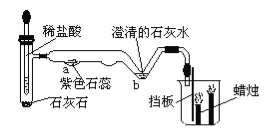
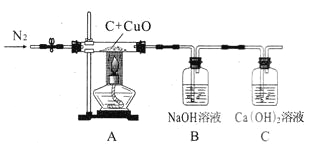
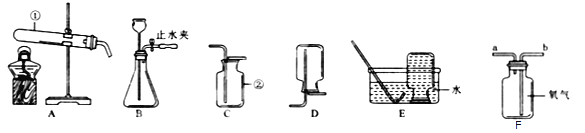题目内容
【题目】某兴趣小组为测定一包石灰石样品中碳酸钙的质量分数,进行实验:往12克的固体样品中不断加入稀盐酸,直到没有气泡产生,共用去稀盐酸100克。测得相关数据如图所示:
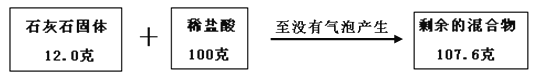
注:①该反应中,样品中的杂质不参加反应,碳酸钙完全反应。
②计算结果保留一位小数。
(1)根据质量守恒定律,反应生成二氧化碳的质量为 g.
(2)计算该样品中碳酸钙的质量分数.(写出计算过程)
【答案】4.4g 83.3%
【解析】
试题分析:根据质量守恒定律,反应前后物质的总质量不变,生成二氧化碳的质量为100g+12.0g107.6g=4.4g;设样品中碳酸钙的质量为x,
则CaCO3 + 2HCl ==CaCl2 + H2O + CO2↑
100 44
x 4.4g
100/x=44/4.4g x=10g
样品中碳酸钙的含量为10g÷12.0g×100%≈83.3%
答:略

【题目】实验室常用的制取气体的发生装置如下:
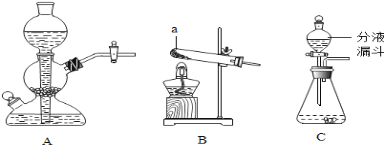
(1)搭建B装置时,酒精灯应在固定仪器a之 (选填(“前” 或“后”)放置,实验结束时应
(2)在实验室制取二氧化碳的研究中,进行了如下实验:
试验编号药品 | 甲 | 乙 | 丙 | 丁 |
大理石 | mg,块状 | mg,块状 | mg,粉末状 | mg,粉末状 |
盐酸(过量) | wg,稀盐酸 | wg,浓盐酸 | wg,稀盐酸 | wg,浓盐酸 |
Ⅰ.上述实验中反应的化学方程式是 .
Ⅱ.若要研究盐酸浓度大小对反应的影响,可选择实验乙与 对照(选填实验编号)
Ⅲ.除盐酸的浓度外,上述实验研究的另一个影响反应快慢的因素是 .
(3)Ⅰ.研究发现酸浓度越大,产生气体的速度越快;浓盐酸有挥发性。与甲比较,对丁分析正确的是 (选填编号)
a.反应更为剧烈 b.最终反应装置中剩余物质的质量更小
c.产生二氧化碳的质量更大 d.粉末状大理石利用率更高
Ⅱ.下表中的两个实验,尽管在原料状态、发生装置等方面存在差异,却都能控制气体较平稳的产生.请从实验目的、原理、原料、装置、操作等方面思考后,具体阐述每个实验中气体较平稳产生的最主要的一个原因。
目的 | 原料 | 发生装置 | 气体较平稳产生的最主要的一个原因 |
制取二氧化碳 | 块状大理石 稀盐酸 | A | |
制取氧气 | 粉末状二氧化锰 3%的过氧化氢溶液 | C |