题目内容
【题目】根据下列实验装置图回答: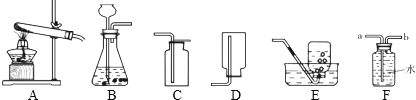
(1)实验室若用A装置制取氧气,反应的化学方程式是;若用E装置
收集的氧气不纯,则可能的原因是(答出一种即可).
(2)实验室用B装置制取氢气,反应的化学方程式是;若用F装置收集氢气,气体应从(填“a”或“b”)端进入.
(3)实验室制取并收集一瓶二氧化碳气体,应选用的装置是(填字母序号),在装入药品前应先 .
(4)当块状石灰石和一定量稀盐酸反应至无气泡产生后,过滤,测得滤液的pH=4,则滤液中所含的阳离子有 .
(5)实验室要制取8.8g二氧化碳,至少需要多少克质量分数为20%的稀盐酸与足量石灰石反应?(写出计算过程)
【答案】
(1)2KClO3![]() 2KCl+3O2↑;没有等到气泡连续均匀冒出,就开始收集
2KCl+3O2↑;没有等到气泡连续均匀冒出,就开始收集
(2)Zn+H2SO4=ZnSO4+H2↑;b
(3)BC;检查装置的气密性
(4)Ca2+、H+
(5)
设所用盐酸中溶质的质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 44
x 8.8g
![]()
x=14.6g
所用盐酸的质量为14.6g÷20%=73g
答:需要溶质的质量分数为20%的盐酸73g.
【解析】解:(1)A装置适用于固体加热制氧气,试管口没有棉花团,所以是加热氯酸钾与二氧化锰的混合物来制取氧气,用排水法收集氧气时,要等到导管口的气泡连续且均匀冒出时才能收集,因为开始冒出的是试管内的空气;所以答案是:2KClO3![]() 2KCl+3O2↑;没有等到气泡连续均匀冒出,就开始收集;(2)在实验室里,常用锌与稀硫酸反应来制取氢气,锌与稀硫酸反应来制取氢气的反应方程式为:Zn+H2SO4=ZnSO4+H2↑;氢气密度比水密度小,若用F进行排水法收集氢气,则气体应从b口进入;所以答案是:Zn+H2SO4=ZnSO4+H2↑;b;(3)实验室制取二氧化碳常用大理石与石灰石与稀盐酸反应,是固液不加热反应,所以可用装置B;二氧化碳的密度大于空气的密度,并且易溶于水,采用向上排空气法收集;在加入试剂前一定要先检查装置的气密性;所以答案是:BC;检查装置的气密性;(4)实验室中用石灰石和稀盐酸反应来制取二氧化碳,该反应生成了氯化钙、水和二氧化碳,其中氯化钙在溶液中以钙离子和氯离子的形式存在,而水以水分子的形式存在,二氧化碳逸出;根据溶液的pH值和溶液的酸碱性的关系可以知道,pH=4的溶液为酸性溶液,HCl过量,则含有氢离子和氯离子;所以答案是:Ca2+、H+;
2KCl+3O2↑;没有等到气泡连续均匀冒出,就开始收集;(2)在实验室里,常用锌与稀硫酸反应来制取氢气,锌与稀硫酸反应来制取氢气的反应方程式为:Zn+H2SO4=ZnSO4+H2↑;氢气密度比水密度小,若用F进行排水法收集氢气,则气体应从b口进入;所以答案是:Zn+H2SO4=ZnSO4+H2↑;b;(3)实验室制取二氧化碳常用大理石与石灰石与稀盐酸反应,是固液不加热反应,所以可用装置B;二氧化碳的密度大于空气的密度,并且易溶于水,采用向上排空气法收集;在加入试剂前一定要先检查装置的气密性;所以答案是:BC;检查装置的气密性;(4)实验室中用石灰石和稀盐酸反应来制取二氧化碳,该反应生成了氯化钙、水和二氧化碳,其中氯化钙在溶液中以钙离子和氯离子的形式存在,而水以水分子的形式存在,二氧化碳逸出;根据溶液的pH值和溶液的酸碱性的关系可以知道,pH=4的溶液为酸性溶液,HCl过量,则含有氢离子和氯离子;所以答案是:Ca2+、H+;
5)解:设所用盐酸中溶质的质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 44
x 8.8g![]()
x=14.6g
所用盐酸的质量为14.6g÷20%=73g
答:需要溶质的质量分数为20%的盐酸73g.
所以答案是:73g.
【考点精析】解答此题的关键在于理解氢气的制取和检验的相关知识,掌握氢气的实验室制法原理:Zn + H2SO4 = ZnSO4 +H2↑;Zn + 2HCl = ZnCl2 +H2↑不可用浓盐酸的原因 浓盐酸有强挥发性 ;不可用浓硫酸或硝酸的原因 浓硫酸和硝酸有强氧化性,以及对书写化学方程式、文字表达式、电离方程式的理解,了解注意:a、配平 b、条件 c、箭号.

 阅读快车系列答案
阅读快车系列答案【题目】如图A~F是实验室制备某些常见气体的装置示意图. 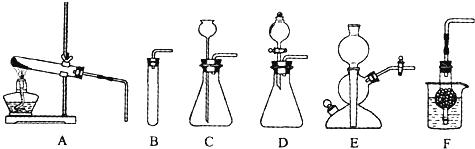
(1)实验室制备CO2的化学方程式为: .
可用的发生装置有:(选填上图字母序号).
(2)装置E或F相对于装置C在操作方面的优势为: .
(3)排水法收集与排空气法收集CO2的比较(分别用体积相同的2个集气瓶收集)
比较项目 | 排水法 | 向上排空气法 |
收集方法可行性分析 | CO2气体生成和从水面逸出的速率远大于其溶解和与水反应的速率 | CO2密度比空气大,且 |
收集过程分析 | 集满现象 | “验满”分析:因气体无色,故集满与否较难确定.即便用燃着木条移近容器口火焰熄灭,也难以证明空气完全排尽 |
向收集到CO2的集气瓶内倒入等体积适量澄清石灰水,并振荡 | 先浑浊后变澄清所需时间较短 | 先浑浊后变澄清所需时间较长 |
由上述实验可得结论 | ①;② | |
【题目】下列各组物质能按照关系图 ![]() (“→”表示反应一步完成)相互转化的是( )
(“→”表示反应一步完成)相互转化的是( )
X | Y | Z | |
A | Cu | CuO | Cu(OH)2 |
B | Ca(OH)2 | Ca(NO3)2 | CaCl2 |
C | Fe2O3 | Fe | FeSO4 |
D | Na2CO3 | NaOH | Na2SO4 |
A.A
B.B
C.C
D.D