题目内容
 某化学兴趣小组使用右图所示装置,对某种铁铜合金的成分进行测量.先取足量稀硫酸于烧杯中,再向其中加入14.0g合金样品开始计时,并将电子天平的读数记录在下表中,请回答下列问题:
某化学兴趣小组使用右图所示装置,对某种铁铜合金的成分进行测量.先取足量稀硫酸于烧杯中,再向其中加入14.0g合金样品开始计时,并将电子天平的读数记录在下表中,请回答下列问题:
(1)根据电子天平读数和时间的关系分析,该反应进行过程中,氢气的产生速度有什么特点?
(2)完全反应后,烧杯中盐的质量分数为多少?(用百分数表示)
(3)合金中铁元素的质量百分含量为多少?
| 空烧杯 | 加入 硫酸后 | 加入铁粉后 5分钟 | 加入铁粉后 12分钟 | 加入铁粉后 21分钟 | 加入铁粉后 40分钟 | 加入铁粉后 3小时 | |
| 读数(g) | 28.5 | 169.7 | 183.6 | 183.5 | 183.4 | 183.3 | 183.3 |
解:(1)因为硫酸的浓度越大,反应越快,随着反应的进行,硫酸的浓度减小,反应速度变慢,所以生成氢气的速度由快变慢.
(2)解:设合金中Fe的质量为x,生成的FeSO4质量为y,
生成氢气的质量为:169.7g+14.0g-183.3g=0.4g,
Fe+H2SO4=FeSO4+H2↑
56 152 2
x y 0.4g
 =
=
 =
=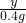
x=11.2g,y=30.4g,
溶液的质量为:11.2g+(169.7g-28.5g)-0.4g=152.0g,
硫酸亚铁的质量分数为: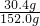 ×100%=20%,
×100%=20%,
答:硫酸亚铁的质量分数为20%.
(3)合金中铁元素的质量分数为: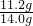 ×100%=80%,
×100%=80%,
答:合金中铁元素的质量分数为80%.
分析:根据表中提供的数据求出生成氢气的质量,再根据化学方程式可以求出其它相关方面的量.
点评:根据表中提供的信息可以判断反应进行的情况,当电子天平读数不再变化时,说明已经完全反应,根据质量差可以求出生成氢气的质量,进一步可以求出其它量.
(2)解:设合金中Fe的质量为x,生成的FeSO4质量为y,
生成氢气的质量为:169.7g+14.0g-183.3g=0.4g,
Fe+H2SO4=FeSO4+H2↑
56 152 2
x y 0.4g
 =
=
 =
=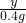
x=11.2g,y=30.4g,
溶液的质量为:11.2g+(169.7g-28.5g)-0.4g=152.0g,
硫酸亚铁的质量分数为:
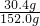 ×100%=20%,
×100%=20%,答:硫酸亚铁的质量分数为20%.
(3)合金中铁元素的质量分数为:
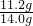 ×100%=80%,
×100%=80%,答:合金中铁元素的质量分数为80%.
分析:根据表中提供的数据求出生成氢气的质量,再根据化学方程式可以求出其它相关方面的量.
点评:根据表中提供的信息可以判断反应进行的情况,当电子天平读数不再变化时,说明已经完全反应,根据质量差可以求出生成氢气的质量,进一步可以求出其它量.

练习册系列答案
相关题目
某化学兴趣小组使用右图所示装置,对某种铁铜合金的成分
进行测量。先取足量稀硫酸于烧杯中,再向其中加入14.0g合金样品
开始计时,并将电子天平的读数记录在下表中,请回答下列问题:
⑴根据电子天平读数和时间的关系分析,该反应进行过程中,氢气
的产生速度有什么特点?
⑵完全反应后,烧杯中盐的质量分数为多少?(用百分数表示)
⑶合金中铁元素的质量百分含量为多少?
| 空烧杯 | 加入 硫酸后 | 加入铁粉后 5分钟 | 加入铁粉后 12分钟 | 加入铁粉后 21分钟 | 加入铁粉后 40分钟 | 加入铁粉后 3小时 | |
| 读数(g) | 28.5 | 169.7 | 183.6 | 183.5 | 183.4 | 183.3 | 183.3 |
 |
 某化学兴趣小组使用右图所示装置,对某种铁铜合金的成分进行测量。先取足量稀硫酸于烧杯中,再向其中加入14.0g合金样品开始计时,并将电子天平的读数记录在下表中,请回答下列问题:
某化学兴趣小组使用右图所示装置,对某种铁铜合金的成分进行测量。先取足量稀硫酸于烧杯中,再向其中加入14.0g合金样品开始计时,并将电子天平的读数记录在下表中,请回答下列问题:
⑴根据电子天平读数和时间的关系分析,该反应进行过程中,氢气
的产生速度有什么特点?
⑵完全反应后,烧杯中盐的质量分数为多少?(用百分数表示)
⑶合金中铁元素的质量百分含量为多少?
| 空烧杯 | 加入 硫酸后 | 加入铁粉后 5分钟 | 加入铁粉 12分钟 | 加入铁粉后 21分钟 | 加入铁粉后 40分钟 | 加入铁粉后 3小时 | |
| 读数(g) | 28.5 |
| 183.6 | 183.5 | 183.4 | 183.3 | 183.3 |
某化学兴趣小组使用右图所示装置,对某种铁铜合金的成分进行测量.先取足量稀硫酸于烧杯中,再向其中加入14.0g合金样品开始计时,并将电子天平的读数记录在下表中,请回答下列问题:
(1)根据电子天平读数和时间的关系分析,该反应进行过程中,氢气的产生速度有什么特点?
(2)完全反应后,烧杯中盐的质量分数为多少?(用百分数表示)
(3)合金中铁元素的质量百分含量为多少?

(1)根据电子天平读数和时间的关系分析,该反应进行过程中,氢气的产生速度有什么特点?
(2)完全反应后,烧杯中盐的质量分数为多少?(用百分数表示)
(3)合金中铁元素的质量百分含量为多少?
| 空烧杯 | 加入 硫酸后 | 加入铁粉后 5分钟 | 加入铁粉后 12分钟 | 加入铁粉后 21分钟 | 加入铁粉后 40分钟 | 加入铁粉后 3小时 | |
| 读数(g) | 28.5 | 169.7 | 183.6 | 183.5 | 183.4 | 183.3 | 183.3 |

 (2013?荆门)某化学兴趣小组使用右图所示装置,对某种铁铜合金的成分进行测量.先取足量稀硫酸于烧杯中,再向其中加入14.0g合金样品开始计时,并将电子天平的读数记录在下表中,请回答下列问题:
(2013?荆门)某化学兴趣小组使用右图所示装置,对某种铁铜合金的成分进行测量.先取足量稀硫酸于烧杯中,再向其中加入14.0g合金样品开始计时,并将电子天平的读数记录在下表中,请回答下列问题: 后
后
 169.7
169.7