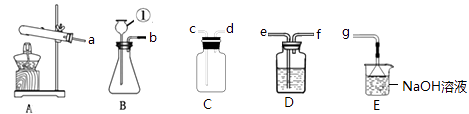
题目内容
【题目】某化学兴趣小组为测定生铁样品中铁的质量分数,他们的实验过程和有关数据如图所示(生铁样品中的杂质不与稀硫酸反应)。请计算:
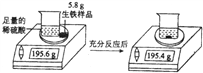
(1)实验中生成气体的质量为____g。
(2)生铁样品中铁的质量分数为________。(结果保留到0.l%)
【答案】 0.2g 96.6%
【解析】(1)据质量守恒定律可知反应前后物质的总质量不变,实验中生成气体的质量为195.6g-195.4g= 0.2g。(2)设生铁样品中铁的质量为x,
Fe+ H2SO4 == FeSO4 + H2↑
56 2
X 0.2g
56/x=2/0.2g x=5.6g
生铁样品中铁的质量分数为5.6g÷5.8g×100%≈96.6%
答:生成氢气的质量为0.2g,生铁样品中铁的质量分数为96.6%。

【题目】某班同学分别用向上排气法(瓶中加2mL水,标为甲)和排水法(瓶里留有2mL水,标为乙)各收集一瓶氧气,然后进行铁丝燃烧的实验,发现:铁丝在甲瓶中不能燃烧,在乙瓶中火星四射。
【提出问题】铁丝燃烧与___________________有关。
【查阅资料】氮气性质稳定,在加热条件下不与铁、碳、氧气等物质反应。
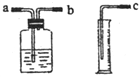
【讨论方案】如果选用如图16所示的仪器收集氧气,仪器接口的连接顺序是_________填“a”“b”或“c”)。
【进行实验】取5根相同的铁丝(直径0.6mm),卷成相同的螺旋状后,分别在体积分数不同的集气瓶中进行实验,如下图所示。实验记录如下:
实验次数 | 氧气的体积分数% | 实验现象 |
第一次 | 90% | 燃烧剧烈,火星四射,燃烧时间长,实验成功 |
第二次 | 80% | 燃烧现象与90%的相比没有明显差异,实验成功 |
第三次 | 70% | 燃烧比80%的弱,燃烧时间比80%的短,实验成功 |
第四次 | 60% | 燃烧比70%的弱,燃烧时间更短,实验成功 |
第五次 | 50% | 铁丝没有燃烧 |
(1)铁丝燃烧的化学方程式为_____________________________________。
(2)通过这组探究实验,可得出的结论是______________________________________。
(3)要研究铁丝的粗细对铁在氧气中燃烧的影响,下列实验能达到目的的是_______________
A.在同一瓶氧气中,先后进行不同粗、细铁丝的燃烧实验
B.在两瓶不同浓度的氧气中,分别同时进行粗、细铁丝的燃烧实验
C.在两瓶相同浓度的氧气中,分别进行粗、细铁丝的燃烧实验
【反思与评价】
(1)对氧气纯度要求较高的实验应采用______________方法收集氧气。
(2)在以上的实验中,某同学将集气瓶中装入一半的水,塞紧瓶塞,再通过排水法收集氧气,当把水排净时,收集到的氧气的体积分数约为(______)
A. 50% B.60% C.70% D.80%