题目内容
【题目】在化学知识中有很多的“相等”。下列说法中不正确的是 ( )
A. 化学反应前后原子的个数相等
B. 化合物中元素化合价的正价总数和负价总数相等
C. 化学反应前后元素的质量相等
D. 在原子中,原子核内质子数和中子数相等
【答案】D
【解析】A.化学反应前后原子的个数相等,遵循质量守恒定律,故A正确;B.化合物中元素化合价的正价总数和负价总数相等,符合电荷守恒,故B正确;C. 化学反应前后元素的质量相等,遵循质量守恒定律,故C正确;D.在原子中,原子核内质子数和核外电子数相等,故D错误。
点睛∶任何化学反应都必然遵循质量守恒定律。

【题目】探究影响化学反应速率的因素
(1)发现和提出问题
镁在空气中能够剧烈燃烧,铁丝在氧气中能够剧烈燃烧,而真金不怕火炼,这说明决定物质之间能否发生反应以及反应速率的内因是 .
蜡烛在氧气中燃烧比在空气中燃烧剧烈,这一事例中影响化学反应速率的因素是;夏天,将食品放在冰箱里不容易变质,这一事例说明温度也能影响化学反应速率,温度如何影响反应速率呢?
(2)猜想与假设
温度越高,反应速率越快
收集证据
实验药品:颗粒大小相同的锌粒;两份相同溶质质量分数.不同温度的稀硫酸(20℃、40℃)
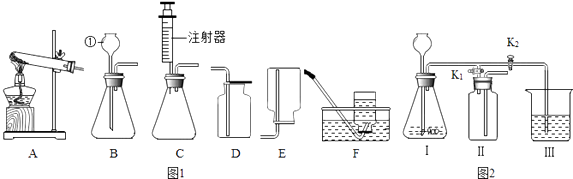
供选仪器:药匙、气体发生装置2套(气密性良好)、量筒2支、分液漏斗、秒表、胶头滴管、水槽、大试管2支.利用上述仪器和药品,补充完成下表的实验报告.
观察或测量的量 | 选用的仪器 | 实验步骤 | 实验现象 | 实验结论 |
产生相同体积(一试管)的气体所需时间 | 气体发生装置、秒表、胶头滴管、水槽、大试管、 | 温度越高,反应速率越快.反应的化学方程式是 |
该实验可以观察或测量的量有多种,除了上述观测点外,可以观察或测量的量还有(写一条) .
(3)结论与解释
从微观的角度分析“温度越高,反应速率越快”的原因是 .
(4)拓展分析
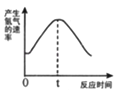
根据其他测定方位,实验小组的同学绘制了锌粒与稀硫酸反应产生氢气的速率随时间变化的曲线,如图所示,请据图分析:时间0﹣t内,反应速率逐渐加快的主要原因是 , 时间t以后,反应速率逐渐减慢的主要原因是 .