题目内容
已知X元素原子最外层有6个电子,Y元素原子最外层有2个电子,则A、B两种元素组成的化合物的化学式可能是( )
分析:根据化合价表示原子之间互相化合的数目和元素最外层电子数的关系进行分析解答;利用最外层电子数推断元素的化合价,再根据元素化合价判断它们形成化合物的化学式.
解答:解:离子所带电荷的数值等于化合价的数值,且正负一致;X元素原子最外层有6个电子,在化学反应中容易得到2个电子,从而带上2个单位的负电荷,故元素X的化合价为-2;Y元素原子最外层有2个电子,在化学反应中容易失去2个电子,从而带上2个单位的正电荷,故元素Y的化合价为+2价;由化合物化学式的书写一般规律:金属在前,非金属在后;氧化物中氧在后,原子个数不能漏,正负化合价代数和为零,所以它们形成化合物的化学式为YX.
故选A.
故选A.
点评:本题难度不是很大,考查学生根据最外层电子数与化合价的关系、利用化合价原则来书写化学式等进行解题的能力.

练习册系列答案
相关题目
已知X原子的最外层电子数为2,Y原子的最外层电子数为7,则由X、Y两种元素组成的化合物的化学式可能是( )
| A、XY2 | B、X2Y7 | C、X2Y3 | D、X7Y2 |
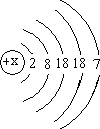 22、已知碘元素(元素符号为I)的原子结构示意图,请回答下列问题.
22、已知碘元素(元素符号为I)的原子结构示意图,请回答下列问题.
 ”表示氯原子,用
”表示氯原子,用 ”表示氯气分子,如图1为A、B两种物质反应的微观过程(恰好完全反应),请你根据图示回答下列问题:
”表示氯气分子,如图1为A、B两种物质反应的微观过程(恰好完全反应),请你根据图示回答下列问题:
 ,请回答下列问题.
,请回答下列问题.