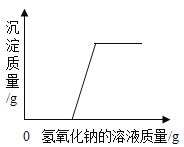
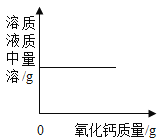
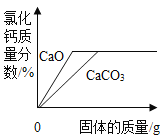
题目内容
【题目】用化学用语填空:
(1)空气中约占78%(体积含量)的气体__________;
(2)硫酸根离子___________;
(3)氢氧化钠____________;
(4)氧化钙中钙元素的化合价_____________;
(5)高原缺氧的“氧”是指__________;
(6)硝酸铁中的阳离子______________。
【答案】N2 SO42- NaOH ![]() O2 Fe3+
O2 Fe3+
【解析】
(1)根据空气的成分解答;
(2)每个硫酸根离子带2个单位负电荷;
(3)根据化学式书写的方法进行书写氢氧化钠的化学式;
(4)化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后;
(5)高原缺氧指的是缺少氧气;
(6)硝酸铁中的阳离子 为铁离子;根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。
(1)在空气中体积分数约占78%的气体是N2(氮气);
(2)硫酸根离子可以表示为SO42-;
(3)化学式书写的方法:将元素符号正价在前,负价在后,标出元素化合价,取正负化合价的最小公倍数,用最小公倍数除去各自化合价的绝对值,将所得商写在对应元素符号右下角。故答案为:NaOH
(4)由化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后,故氧化钙中钙元素的化合价为+2价可表示为:![]() 。
。
(5)氧气是一种双原子分子,其化学式为:O2;
(6)硝酸铁中的阳离子 为铁离子,表示为:Fe3+; 故答案为:Fe3+;

【题目】请根据下列各图中提供的信息回答问题。
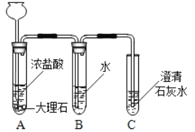
I.实验室制备并收集二氧化碳。
选用药品。按下表进行实验,取等质量的大理石加入足量酸中(杂质不与酸反应),产生二氧化碳体积随时间变化曲线如图所示。(提示:硫酸钙微溶于水)
实验编号 | 药品 |
Ⅰ | 块状大理石、10% H2SO4溶液 |
Ⅱ | 块状大理石、7% HCl溶液 |
Ⅲ | 大理石粉末、7% HCl溶液 |
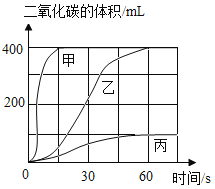
图中丙对应实验________(选填“Ⅰ”、“Ⅱ”或“Ⅲ”)确定用乙对应的药品制备并收集二氧化碳,反应的化学方程式是_____________________。
Ⅱ.利用以下实验装置进行实验,请回答下列问题。
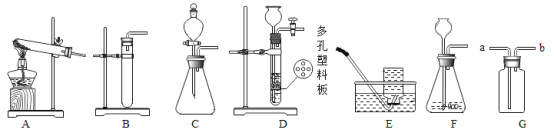
(1)加热高锰酸钾制取并收集较为纯净的氧气,选用的装置是_________(填写字母)。写出反应的化学方程式_______________________。
(2)装置D、F都可用来制取二氧化碳,装置D相对于装置F的优势是______________。若用G装置收集二氧化碳,气体应从____________(填a或b)端进入。