题目内容
【题目】钠的化合物在日常生活中有着广泛的应用.
(1)食盐主要成分为氯化钠,氯化钠是由构成(填符号).
(2)某氯化钠样品中含有少量CaCl2和MgCl2 , 实验室进行提纯的流程如图1.回答下列问题: 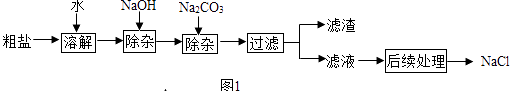
①除杂时发生反应的化学方程式为 .
②本实验中加入Na2CO3是为了除去 , 过量的NaOH和Na2CO3可加足量的除去.
(3)向氢氧化钠溶液中不断滴入盐酸,得到如图2的曲线,a点时溶液中的溶质是 . 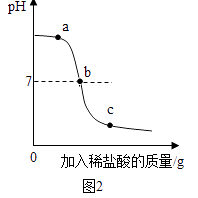
(4)食用纯碱中常含有少量的氯化钠.现取某食用纯碱样品10g加入一定量稀盐酸中,恰好完全反应,同时产生了3.3g气体.试计算该食用纯碱中碳酸钠的质量分数(写出计算过程).
【答案】
(1)Na+和Cl﹣
(2)MgCl2+2NaOH=Mg(OH)2↓+2NaCl、CaCl2+Na2CO3=CaCO3↓+2NaCl.;氯化钙;稀盐酸.
(3)氯化钠和氢氧化钠.
(4)解:设参加反应的碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+ | CO2↑ |
106 | 44 |
x | 3.3g |
![]() =
= ![]()
x=7.95
该食用纯碱中碳酸钠的质量分数为 ![]() ×100%=79.5%
×100%=79.5%
答:该食用纯碱中碳酸钠的质量分数为79.5%.
【解析】解:(1)食盐主要成分为氯化钠,氯化钠是由 Na+和Cl﹣构成.(2)①除杂时加入氢氧化钠时为了除去氯化镁,对应的反应为氯化镁和氢氧化钠反应生成氢氧化镁和氯化钠;加入碳酸钠的目的是除去氯化钙,对应的反应是氯化钙和碳酸钠反应生成碳酸钙和氯化钠,对应的化学方程式为 MgCl2+2NaOH=Mg(OH)2↓+2NaCl、CaCl2+Na2CO3=CaCO3↓+2NaCl.②本实验中加入Na2CO3是为了除去 氯化钙,为避免引入新的杂质,而实验最终要得到纯净的氯化钠,所以去除过量的NaOH和Na2CO3可加足量的稀盐酸.(3)向氢氧化钠溶液中不断滴入盐酸,由于加入盐酸生成了氯化钠,而a点时溶液显碱性也就是有剩余的氢氧化钠,所以此时溶液中的溶质是生成的氯化钠和剩余的氢氧化钠(4)设参加反应的碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+ | CO2↑ |
106 | 44 |
x | 3.3g |
![]() =
= ![]()
x=7.95
该食用纯碱中碳酸钠的质量分数为 ![]() ×100%=79.5%
×100%=79.5%
【考点精析】本题主要考查了根据化学反应方程式的计算的相关知识点,需要掌握各物质间质量比=系数×相对分子质量之比才能正确解答此题.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案