题目内容
(2004?天津)请按要求回答下列问题: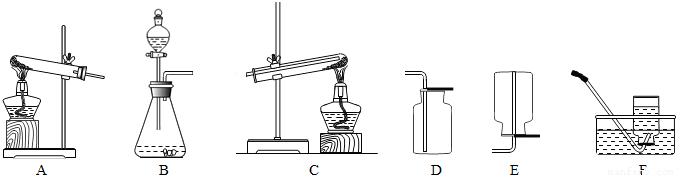
(1)根据下表的实验内容,从上图中选择合适的装置,填入表中.
| 实验内容 | 选用的仪器装置(填字母) |
| 制取和收集氧气 | ______ |
| 制取和收集氢气 | ______ |
| 氢气还原氧化铜 | ______ |
| 制取和收集二氧化碳 | ______ |
【答案】分析:实验室制取气体的发生装置选择的依据为反应物的状态和反应的条件,收集装置的选择依据气体本身的密度、溶解性等物理性质;氢气还原氧化铜的装置是C装置,反应的现象为试管中黑色粉末逐渐变为光亮的红色,同时管口有水滴生成;在实验室中,加热氯酸钾和二氧化锰的混合物制取氧气的反应原理为2KClO3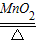 2KCl+3O2↑;欲从高锰酸钾受热分解后的残渣中回收二氧化锰,生成物中只有二氧化锰不溶于水,所以,从液体中分离不溶性固体的方法为过滤;若取质量均为m g的镁和铁,分别投入到50g溶质质量分数相同的硫酸中,充分反应后,均产生0.2g氢气,根据化学方程式计算可得出消耗镁的质量为2.4g,消耗铁的质量为5.6g,加入的镁、铁质量相等,因此剩余的金属一定是镁;m的值一定不小于5.6g;产生0.2g,消耗硫酸的质量为9.8g,所以所用硫酸溶液中溶质的质量分数为19.6%.
2KCl+3O2↑;欲从高锰酸钾受热分解后的残渣中回收二氧化锰,生成物中只有二氧化锰不溶于水,所以,从液体中分离不溶性固体的方法为过滤;若取质量均为m g的镁和铁,分别投入到50g溶质质量分数相同的硫酸中,充分反应后,均产生0.2g氢气,根据化学方程式计算可得出消耗镁的质量为2.4g,消耗铁的质量为5.6g,加入的镁、铁质量相等,因此剩余的金属一定是镁;m的值一定不小于5.6g;产生0.2g,消耗硫酸的质量为9.8g,所以所用硫酸溶液中溶质的质量分数为19.6%.
解答:解:(1)实验室制氧气方法为加热高锰酸钾固体,氧气不易溶于水,密度大于空气密度;实验室制氢气药品为金属锌与稀硫酸,氢气难溶于水,密度小于空气密度;实验室制二氧化碳药品为石灰石和稀盐酸,二氧化碳能溶于水,密度大于空气密度;
(2)在实验室中,加热氯酸钾和二氧化锰的混合物制取氧气的反应原理为2KClO3 2KCl+3O2↑;锰酸钾溶于水,二氧化锰不溶于水,可用溶解、过滤的方法提纯二氧化锰;
2KCl+3O2↑;锰酸钾溶于水,二氧化锰不溶于水,可用溶解、过滤的方法提纯二氧化锰;
(3)氢气还原氧化铜的装置是C装置,反应的现象为试管中黑色粉末逐渐变为光亮的红色,同时管口有水滴生成;
(4)产生0.2g氢气时消耗镁的质量为2.4g,消耗铁的质量为5.6g,因此剩余的金属一定是镁,m的值一定不小于5.6g;产生0.2g,消耗硫酸的质量为9.8g,所以所用硫酸溶液中溶质的质量分数为19.6%.
故答案为
(1)AF(或AD);BF(或BE);C;BD
(2)2KClO3 2KCl+3O2↑;②
2KCl+3O2↑;②
(3)试管中黑色粉末逐渐变为光亮的红色,同时管口有水滴生成
(4)①镁;②m≥5.6;2.4g③19.6%
点评:此题考查的知识点较多,包括气体的制取、氢气的性质和根据化学方程式的计算等.解决问题时要抓住问题的关键点,将实验基础知识与物质的性质和化学计算紧密的联系起来.
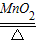 2KCl+3O2↑;欲从高锰酸钾受热分解后的残渣中回收二氧化锰,生成物中只有二氧化锰不溶于水,所以,从液体中分离不溶性固体的方法为过滤;若取质量均为m g的镁和铁,分别投入到50g溶质质量分数相同的硫酸中,充分反应后,均产生0.2g氢气,根据化学方程式计算可得出消耗镁的质量为2.4g,消耗铁的质量为5.6g,加入的镁、铁质量相等,因此剩余的金属一定是镁;m的值一定不小于5.6g;产生0.2g,消耗硫酸的质量为9.8g,所以所用硫酸溶液中溶质的质量分数为19.6%.
2KCl+3O2↑;欲从高锰酸钾受热分解后的残渣中回收二氧化锰,生成物中只有二氧化锰不溶于水,所以,从液体中分离不溶性固体的方法为过滤;若取质量均为m g的镁和铁,分别投入到50g溶质质量分数相同的硫酸中,充分反应后,均产生0.2g氢气,根据化学方程式计算可得出消耗镁的质量为2.4g,消耗铁的质量为5.6g,加入的镁、铁质量相等,因此剩余的金属一定是镁;m的值一定不小于5.6g;产生0.2g,消耗硫酸的质量为9.8g,所以所用硫酸溶液中溶质的质量分数为19.6%.解答:解:(1)实验室制氧气方法为加热高锰酸钾固体,氧气不易溶于水,密度大于空气密度;实验室制氢气药品为金属锌与稀硫酸,氢气难溶于水,密度小于空气密度;实验室制二氧化碳药品为石灰石和稀盐酸,二氧化碳能溶于水,密度大于空气密度;
(2)在实验室中,加热氯酸钾和二氧化锰的混合物制取氧气的反应原理为2KClO3
 2KCl+3O2↑;锰酸钾溶于水,二氧化锰不溶于水,可用溶解、过滤的方法提纯二氧化锰;
2KCl+3O2↑;锰酸钾溶于水,二氧化锰不溶于水,可用溶解、过滤的方法提纯二氧化锰;(3)氢气还原氧化铜的装置是C装置,反应的现象为试管中黑色粉末逐渐变为光亮的红色,同时管口有水滴生成;
(4)产生0.2g氢气时消耗镁的质量为2.4g,消耗铁的质量为5.6g,因此剩余的金属一定是镁,m的值一定不小于5.6g;产生0.2g,消耗硫酸的质量为9.8g,所以所用硫酸溶液中溶质的质量分数为19.6%.
故答案为
(1)AF(或AD);BF(或BE);C;BD
(2)2KClO3
 2KCl+3O2↑;②
2KCl+3O2↑;②(3)试管中黑色粉末逐渐变为光亮的红色,同时管口有水滴生成
(4)①镁;②m≥5.6;2.4g③19.6%
点评:此题考查的知识点较多,包括气体的制取、氢气的性质和根据化学方程式的计算等.解决问题时要抓住问题的关键点,将实验基础知识与物质的性质和化学计算紧密的联系起来.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
