题目内容
【题目】某兴趣小组同学利用下列装置制取气体并探究气体的某些性质。

(1)制取气体:(如图1)
①若选择A与C组合制取氧气,反应的化学方程式为_________________________;
②用石灰石和稀盐酸制取CO2,选用的发生与收集装置组合是___________(填标号)。连接好装置,将药品加入装置前应进行的操作是___________;
(2)探究气体的性质:(如图2)
某同学在空气中点燃镁条,想利用CO2来熄灭燃烧的镁条,结果发现镁条没有熄灭反而剧烈燃烧,集气瓶内壁出现黑色固体,瓶底出现白色固体,实验过程如图2所示。请回答:
①夹持镁条的仪器名称是_________;
②生成的黑色固体是_____________(写化学式);
③查阅资料:MgO、Mg(OH)2、MgCO3均为难溶于水的白色固体。
同学讨论后一致认为,上述3种含镁的化合物中,白色固体不可能的化合物是_________;
④为进一步确定白色固体的成分,进行如下实验:
实验操作 | 实验现象 | 实验结论 |
取白色固体于试管中,加入足量稀硫酸 | _______________ | 白色固体不是 MgCO3, 而是 MgO |
⑤通过上述探究,你对燃烧或灭火的新认识是_______________________________。
【答案】 2KMnO4![]() K2MnO4+MnO2+O2↑或2KClO3
K2MnO4+MnO2+O2↑或2KClO3![]() 2KCl+3O2↑ BE 检查装置的气密性 坩埚钳 C Mg(OH)2 固体溶解,无气泡产生 燃烧不一定需要氧气参加或活泼金属着火不能用二氧化碳灭火等
2KCl+3O2↑ BE 检查装置的气密性 坩埚钳 C Mg(OH)2 固体溶解,无气泡产生 燃烧不一定需要氧气参加或活泼金属着火不能用二氧化碳灭火等
【解析】本题主要考查常用气体的发生装置和收集装置与选取方法,实验室制取氧气的反应原理。要熟悉各种仪器的名称、用途和使用方法,高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气;并回顾操作步骤:“查装定点收移熄”;氧气的密度比空气大;
实验室通常用大理石或石灰石和稀盐酸在常温就能反应制取二氧化碳。
(1)①选择A与C组合制取氧气,由图可知反应条件是加热,所以是用高锰酸钾或氯酸钾,反应的化学方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑或
K2MnO4+MnO2+O2↑或
2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
②制取CO2在常温下就能进行,所以发生装置选B,CO2密度比空气大,能溶于水,所以收集装置选E。实验前需要检查气密性。故填:B、E 检查气密性
(2)①由图可知夹持镁条的仪器是坩埚钳。故填:坩埚钳
②镁在二氧化碳中燃烧生成氧化镁和碳,所以黑色固体是碳。故填:C
③由质量守恒定律可知在反应前后元素的种类不变,反应前有镁、氧、碳,无氢元素,不可能是氢氧化镁。故填:Mg(OH)2
④由结论可知,氧化镁能与硫酸反应生成水和硫酸镁。故填:固体溶解,无气泡产生
⑤镁能在二氧化碳中燃烧,说明不需要氧气也能燃烧。故填:. 燃烧不一定需要氧气

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案【题目】某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气中O2的体积百分数。
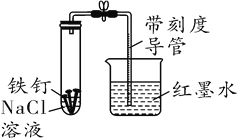
(1)实验前用10%的H2SO4溶液清洗铁钉至有气泡产生。用H2SO4溶液清洗的目的是__________。写出有关化学方程式______________________________。
(2)已知试管剩余空间和导管的体积为40 mL,导管截面积约为1 cm2,形成稳定液柱时,读取读数为8.2 cm。则空气中氧气的体积分数为______%。
(3)实验时发现上述测量过程因反应较慢耗时较长,对其影响因素作如下分析:
【提出假设】假设一:溶液的pH不同;
假设二:NaCl溶液的浓度不同;
请你再提出一种假设,假设三:______________________________不同。
【进行实验】借助上述实验装置,通过取体积、浓度相同NaCl溶液调节溶液的pH获得了如下实验数据:
pH | 2.0 | 5.5 | 6.0 | 6.5 | 7.0 | 8.0 |
液柱高度(cm) | 0 | 1.3 | 8.2 | 8.2 | 8.2 | 8.2 |
形成稳定液柱时间(min) | 3.0 | 3.0 | 5.1 | 5.3 | 15.6 | 17.5 |
【实验结论】根据实验数据分析,为缩短实验测定时间,pH的最佳范围是____________。
【实验反思】当pH=2时,没有观察到稳定液柱形成的原因是________________。
【注意:如果能正确回答下列问题,将奖励4分,但化学试卷总分不超过60分】
请你设计实验,探究NaCl溶液的浓度对铁生锈速率的影响。
实验步骤: __________________________________________________________。
实验现象:________________________________________________________________。