题目内容
【题目】取锌、铜的混合物8g与154.7g稀硫酸恰好完全反应,称得剩余物质的总质量为162.5g。
请计算:
(1)产生氢气的质量是多少?
(2)反应后所得溶液中溶质的质量分数是多少?
【答案】(1)0.2g;(2)10%
【解析】
试题分析:由质量守恒定律,减少的质量即为未称到的气体的质量;溶液中溶质的质量分数=溶质质量/溶液质量×100%,那么由氢气的质量结合方程式求出反应后溶质硫酸锌的质量,锌的质量,再由质量守恒定律求得溶液的质量,代入公式求解。
(1)H2的质量是 154.7 g +8g-162.5 =0.2g
Zn + H2SO4===ZnSO4+ H2↑
65 161 2
X Y 0.2g
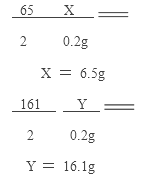
(2)所得溶液的质量为:6.5g+154.7g-0.2g=161g 或162.5g-(8g-6.5g)=161g
所得溶液中溶质的质量分数为![]() =10%
=10%
答:略。(单位和百分号都不在扣分范围内)

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】为探究氢氧化钙溶液和稀盐酸反应所得溶液中溶质的成分,小鸣和同学们通过测定了反应后溶液的pH,得到了如下图所示的pH曲线,请回答:
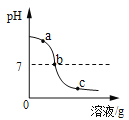
(1)由图可知该实验操作是将__________滴加到另一种溶液中;
(2)该反应的化学方程式为___________;
(3)实验过程中,小鸣取了a、b、c三处反应后的溶液于三个烧杯中,却忘了作标记,请你设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液。
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3=CaCO3↓+2NaCl。
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现___________的现象。结论:该样品是a处溶液。
②为进一步确定b或c处溶液,又设计了以下方案:
实验步骤 | 实验现象 | 实验结论 |
另取余下样品少量于两支试管中,分别滴加足量的Na2CO3溶液。 | ________ | 该样品为b处溶液。 |
【反思评价】探究反应后溶液中溶质的成分,除了要考虑生成物之外,还要考虑____________。

