题目内容
 (2012?栖霞区二模)某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.
(2012?栖霞区二模)某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.(1)配制150g质量分数为8% 的氢氧化钠溶液.
①计算:需要氢氧化钠固体的质量为
12
12
g,水的体积为138
138
mL(水的密度近似看作1g/cm3).②称量:调节托盘天平平衡后,将烧杯放在托盘天平的左盘,称量其质量.然后
BA
BA
(按操作的先后顺序选填字母),直至天平平衡.A.将氢氧化钠固体加入烧杯中 B.按需要添加砝码、移动游码
③溶解:用量筒量取所需的水,倒入盛有氢氧化钠固体的烧杯里,搅拌,使其溶解,并冷却至室温.
④把配好的溶液装入试剂瓶,塞好橡皮塞并贴上标签.
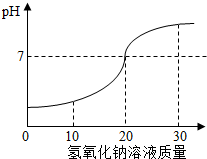
(2)如图表示向20g某稀盐酸中逐滴加入氢氧化钠溶液时PH的变化情况.
①根据曲线判断,当加入25g氢氧化钠溶液时,所得溶液中的溶质为
NaCl、NaOH
NaCl、NaOH
(写化学式).②该盐酸中溶质质量分数为
7.3%
7.3%
.③反思:氢氧化钠具有较强的吸水性,若称取的氢氧化钠已部分吸水,则所求得的盐酸中溶质质量分数将
偏大
偏大
(填“偏大”“偏小”或“无影响”).分析:(1)①根据溶质的质量=溶液的质量×溶质的质量分数 以及溶剂的质量=溶液的质量-溶质的质量计算;
②根据质量来称量药品的步骤分析;
(2)①加入25g氢氧化钠溶液时氢氧化钠过量,通过分析反应后存在的溶质考虑;②根据图象可知反应完毕消耗氢氧化钠溶液的质量为20g,再乘以氢氧化钠的质量分数,算出氢氧化钠的质量,再通过计算算出氯化氢的质量,再除以盐酸的质量即可;③根据氢氧化钠吸水后配制的氢氧化钠溶液的实际溶质质量分数偏小,导致需要的氢氧化钠溶液增加,根据方程式计算的氯化氢变多,则溶质质量分数偏大.
②根据质量来称量药品的步骤分析;
(2)①加入25g氢氧化钠溶液时氢氧化钠过量,通过分析反应后存在的溶质考虑;②根据图象可知反应完毕消耗氢氧化钠溶液的质量为20g,再乘以氢氧化钠的质量分数,算出氢氧化钠的质量,再通过计算算出氯化氢的质量,再除以盐酸的质量即可;③根据氢氧化钠吸水后配制的氢氧化钠溶液的实际溶质质量分数偏小,导致需要的氢氧化钠溶液增加,根据方程式计算的氯化氢变多,则溶质质量分数偏大.
解答:解:(1)①溶质的质量=溶液的质量×溶质的质量分数=150g×8%=12g 水的质量=150g-12g=138g∴水的体积=
=138mL;
②已知需要称量12g的氢氧化钠,应该先添加好砝码和游码,再加氢氧化钠到天平平衡,故操作顺序是BA;
(2)①向稀盐酸中逐滴加入氢氧化钠溶液发生反应生成氯化钠和水,当加入25g氢氧化钠溶液时氢氧化钠过量,故溶液中的溶质有生成的氯化钠和过量的氢氧化钠,
化学式为:NaCl、NaOH;
②向20g某稀盐酸中逐滴加入氢氧化钠溶液20g时恰好完全反应
设该稀盐酸中HCl的质量为X
HCl+NaOH=NaCl+H20
36.5 40
X 20g×8%
=
X=1.46g
稀盐酸的质量分数为:
×100%=7.3%
答:该稀盐酸中溶质的质量分数为7.3%
③氢氧化钠吸水后导致实际氢氧化钠的质量少,因而配制的氢氧化钠溶液的实际溶质质量分数偏小,导致反应时需要的氢氧化钠溶液增加,根据方程式计算的氯化氢变多,则溶质质量分数偏大.
故答案为:(1)①12g,138;②BA;(2)①NaCl、NaOH;②7.3%;③偏大
| 138g |
| 1g/mL |
②已知需要称量12g的氢氧化钠,应该先添加好砝码和游码,再加氢氧化钠到天平平衡,故操作顺序是BA;
(2)①向稀盐酸中逐滴加入氢氧化钠溶液发生反应生成氯化钠和水,当加入25g氢氧化钠溶液时氢氧化钠过量,故溶液中的溶质有生成的氯化钠和过量的氢氧化钠,
化学式为:NaCl、NaOH;
②向20g某稀盐酸中逐滴加入氢氧化钠溶液20g时恰好完全反应
设该稀盐酸中HCl的质量为X
HCl+NaOH=NaCl+H20
36.5 40
X 20g×8%
| 36.5 |
| 40 |
| X |
| 20g×8% |
X=1.46g
稀盐酸的质量分数为:
| 1.46g |
| 20g |
答:该稀盐酸中溶质的质量分数为7.3%
③氢氧化钠吸水后导致实际氢氧化钠的质量少,因而配制的氢氧化钠溶液的实际溶质质量分数偏小,导致反应时需要的氢氧化钠溶液增加,根据方程式计算的氯化氢变多,则溶质质量分数偏大.
故答案为:(1)①12g,138;②BA;(2)①NaCl、NaOH;②7.3%;③偏大
点评:本题作用考查了溶液的配制的有关计算和操作步骤,并进行化学方程式的计算、误差分析等内容,这是学生学习的重点,也是易错点,关键要根据溶质质量分数定义进行理解、运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2012?栖霞区二模)两种不含结晶水的固体物质a、b的溶解度曲线如图,下列说法正确的是( )
(2012?栖霞区二模)两种不含结晶水的固体物质a、b的溶解度曲线如图,下列说法正确的是( )