题目内容
(1)用化学符号表示:
①地壳在含量最多的金属元素 ;
②氧化镁中阳离子 .
(2)化学与人类的生产、生活密切相关.
①铁锅常用于炒饭炒菜,是利用了铁的 性;
②化学电池是将化学能直接转化为 的装置.
①地壳在含量最多的金属元素
②氧化镁中阳离子
(2)化学与人类的生产、生活密切相关.
①铁锅常用于炒饭炒菜,是利用了铁的
②化学电池是将化学能直接转化为
考点:化学符号及其周围数字的意义,金属的物理性质及用途,物质发生化学变化时的能量变化
专题:化学用语和质量守恒定律
分析:(1)根据地壳中含量最多的前五种元素:氧、硅、铝、铁、钙,和离子的表示方法进行解答;
(2)根据铁的物理性质与用途和化学电源是一种能将化学能直接转变成电能的装置进行分析解答即可.
(2)根据铁的物理性质与用途和化学电源是一种能将化学能直接转变成电能的装置进行分析解答即可.
解答:解:(1)①地壳中含量最多的前五种元素:氧、硅、铝、铁、钙,汉字中带钅字旁(汞和金除外)的属于金属元素,所以地壳中含量最多的金属元素是铝,其元素符号为:Al;
②氧化镁中阳离子是镁离子,根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.故镁离子可表示为:Mg2+;
(2)①生活中常用铁锅炒菜,主要利用了铁具有良好的导热性;
②化学电源又称电池,是一种能将化学能直接转变成电能的装置.
故答案为:(1)①Al;②Mg2+;(2)①导热;②电能.
②氧化镁中阳离子是镁离子,根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.故镁离子可表示为:Mg2+;
(2)①生活中常用铁锅炒菜,主要利用了铁具有良好的导热性;
②化学电源又称电池,是一种能将化学能直接转变成电能的装置.
故答案为:(1)①Al;②Mg2+;(2)①导热;②电能.
点评:此题考查了化学符号的书写和铁的物理性质以及化学电源在实际生活中的利用的问题,解答时,必须熟练掌握基本知识,这是解答本类题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2008年6月14日是我国第三个“文化遗产日”.其制作过程主要属于化学变化( )
A、 永康锡艺 |
B、 浦江剪纸 |
C、 义乌米酒 |
D、 东阳木雕 |
有一种含CaCO3与CaO的混合物,取该混合物16g,经高温煅烧后,将剩余固体投入足量水中,固体全部溶解生成Ca(OH)2,生成的Ca(OH)2质量为22.2g,则原混合物中钙元素质量分数为( )
| A、40% | B、50% |
| C、75% | D、45% |
下列实验操作,错误的是( )
A、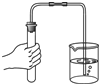 |
B、 |
C、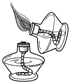 |
D、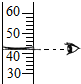 |
 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究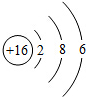 R元素的原子结构示意图如图所示,其原子的最外层电子数
R元素的原子结构示意图如图所示,其原子的最外层电子数 A、B、C、D四种物质是初中常见的物质,它们的转化关系如图所示,试解答下列问题:
A、B、C、D四种物质是初中常见的物质,它们的转化关系如图所示,试解答下列问题: