题目内容
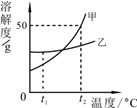
【题目】某化学兴趣小组的同学,对实验室制取二氧化碳后残余溶液的溶质成分进行了相关探究。取适量残余溶液放入烧杯中,向其中逐滴加入过量某物质X,烧杯中溶液的pH随滴入X的量的变化关系如图所示。
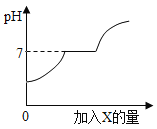
(1)根据图像可知,原残余溶液中溶质的成分是________。(填化学式)
(2)则X可能是下列哪种物质________(填序号)
A 水 B 澄清石灰水 C 纯碱溶液 D 稀盐酸
【答案】HCl、CaCl2 C
【解析】
(1)实验室制取二氧化碳是碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,溶液的起点小于7,所以溶液显酸性,说明反应物稀盐酸过量,所以原残余溶液中溶质的成分是:HCl、CaCl2;
(2)由图可以看出,当加入X物质时,遇到盐酸会反应,pH增加,之后随着盐酸的消耗,加入物质能够与氯化钙反应,但是对应生成物必须是中性的,而继续加入X,溶液显碱性。
A、HCl与CaCl2的混合溶液显酸性,加入水时溶液的pH升高,但是不会等于或大于7,不符合题意;
B、加入石灰水时,氢氧化钙能和盐酸反应生成氯化钙和水,溶液的pH升高。当酸完全被消耗之后,继续滴加石灰水,由于氢氧化钙和氯化钙不反应,氢氧化钙溶液本身显碱性,所以pH值马上大于7,而不会出现水平等于7的一段,不符合题意;
C、加入纯碱溶液时,碳酸钠能和盐酸反应,也能和氯化钙反应。开始时碳酸钠和盐酸反应生成氯化钠、水、二氧化碳,导致pH上升;当酸完全被消耗时,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,生成物都是中性的,一直到氯化钙被完全消耗;当继续滴加碳酸钠时,由于碳酸钠显碱性,所以pH大于7,符合题意;
D、加入盐酸时,盐酸和氯化钙不反应,溶液的pH不能等于或大于7,不符合题意。故选C。

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案【题目】甲、乙、丙三种物质的转化关系如下图所示(“→”表示反应一步实现,部分物质和反应条件已略去)。下列选项不能实现图示转化的是( )
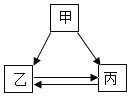
选项 | 甲 | 乙 | 丙 |
A | H2SO4 | H2 | H2O |
B | C | CO | CO2 |
C | CuSO4 | Cu(OH)2 | CuCl2 |
D | NaOH | NaCl | NaNO3 |
A.AB.BC.CD.D
【题目】小兰用图示装置验证CO2能与NaOH发生化学反应。推注射器活塞向充满CO2的集气瓶(甲)中注入过量的NaOH溶液,振荡集气瓶后打开止水夹。(不考虑微溶物)

(1)向甲中注入NaOH溶液发生的化学反应方程式:______________
(2)打开止水夹后观察到:乙中液体__________,且甲中的液体变浑浊。上述现象证明CO2能与NaOH发生化学反应。
(3)反应后将甲中混合物过滤,得到白色沉淀和无色滤液。小兰欲探究无色滤液中的溶质成分:小兰分析得出无色滤液中一定含__________。(填化学式)
(提出问题)无色滤液中还含有哪些溶质?
(做出猜想)①Na2CO3; ②CaCl2; ③CaCl2和Na2CO3; ④无其他溶质。
小兰认为猜想__________定不正确。(填数字番号)
(进行实验)
实验步骤 | 实验现象 | 实验结论 |
①取少量滤液于试管中,滴加少量_______溶液 | 无明显现象 | 猜想________成立 |
②取少量滤液于试管中,滴加足量稀盐酸 | 有气泡产生 |
(实验交流)
小梅将步骤③中盐酸改为少量进行实验,没有观察到气泡(其他步骤和现象不变),小梅认为猜想④成立,你认为小梅的判断是否正确?请简述原因_______________。