题目内容
取氯化钙和氯化钠的混合物10g,加水使其完全溶解得到溶液50g,再加入50g碳酸钠溶液恰好完全反应,过滤,所得沉淀中含2g钙元素(不考虑实验过程中质量损失)。
计算:
(1)混合物中氯化钙的质量分数。
(2)将反应后的溶液蒸发掉12.6g水没有晶体析出,求所得溶液中溶质质量分数。
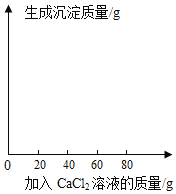
某食用碱的主要成分是Na2CO3,其中含有少量的NaCl,小明同学为测定该食用碱中Na2CO3的质量分数,他进行了以下实验,取40 g食用碱,加水配成400g的溶液,把溶液平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见下表:
实验一 | 实验二 | 实验三 | 实验四 | |
食用碱溶液的质量 | 100g | 100g | 100g | 100g |
加入CaCl2溶液的质量 | 20g | 40g | 60g | 80g |
生成沉淀的质量 | 2.5g | 5g | m | 8g |
请分析表中数据并计算回答。
(1)m=________;
(2)40 g该食用碱配成的溶液与足量CaCl2溶液反应,最多生成沉淀质量为多少;
(3)该食用碱中Na2CO3的质量分数是?(写出计算过程,答案精确到0.1%)
(4)请根据实验四的数据画图并标上合适的坐标。
下表是硝酸钾和氯化铵在不同温度时的溶解度。分析表中数据,回答问题。
温度/℃ | 0 | 20 | 40 | 60 | |
溶解度/g | 硝酸钾 | 13.3 | 31.6 | 63.9 | 110 |
氯化铵 | 29.4 | 37.2 | 45.8 | 55.2 |

(1)上图中,甲可表示___(填化学式)的溶解度曲线。
(2)40℃时,两种物质的饱和溶液中,溶质质量分数较小的是__(填化学式)。
(3)20℃时,按下图所示操作,B中溶液的溶质与溶剂质量比为_____(填最简整数比);C中的溶液是__(填“饱和”或“不饱和”)溶液。

(4)60℃时,将两种物质的饱和溶液各100g,分别加热蒸发10g水后,再恢复到60℃,剩余溶液的质量:硝酸钾溶液__(填“>”“<”或“=”)氯化铵溶液。
(5)室温下,将盛有硝酸钾的饱和溶液的试管放入盛有水的烧杯中,再向烧杯内的水中加入一定量的硝酸铵并搅拌,试管内可以观察到的现象是____。



 甲醛 B.
甲醛 B. 酒精
酒精 烧碱 D.
烧碱 D. 浓硫酸
浓硫酸