题目内容
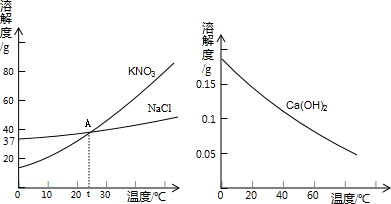
下图是常见固体物质的溶解度曲线,根据图示回答:
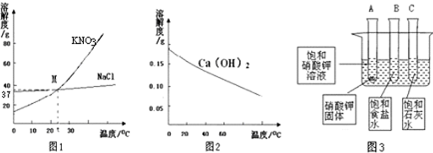
(1)图1中曲线上点M表示______.
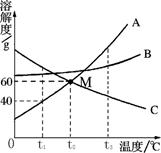
(2)有A、B、C三只试管放在盛有冷水的烧杯中(如图3所示),向烧杯中加入适量浓硫酸,观察到______,此时B试管中溶液的状态______(填“饱和”或“不饱和”)
(3)t℃时,将40g食盐放入100g水中充分溶解,所得溶液中溶质的质量分数约为______.
解:1)图1中曲线上点M是t°C时,硝酸钾和氯化钠的溶解度曲线的交点,表示该温度下两物质的溶解度相等;
(2)氯化钠的溶解度随温度的升高而增大,但变化不大,硝酸钾的溶解度随温度的升高而增大,且变化较大,氢氧化钙的溶解度随温度的升高而减小,故将A、B、C三只试管放在盛有冷水的烧杯中,向烧杯中加入适量浓硫酸,浓硫酸溶于水使溶液温度升高,则A中硝酸钾的溶解度增大,固体会减少,食盐的主要成分是氯化钠,则B中氯化钠溶解度稍微变大,饱和食盐水变为不饱和,C中氢氧化钙的溶解度减小,有氢氧化钙固体析出,溶液变浑浊;
(3)观察图示:t℃时氯化钠的溶解度大约是37g,所以将40g食盐放入100g水中充分溶解,所得溶液中溶质的质量分数约为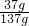 ×100%≈27%;
×100%≈27%;
故答案为:(1)t°C时,硝酸钾和氯化钠的溶解度相同;
(2)A中固体减少,C中出现浑浊; 不饱和;
(3)27%.
分析:(1)溶解度曲线的交点表示该温度下两物质的溶解度相等;
(2)据氯化钠、硝酸钾、氢氧化钙的溶解度随温度的升高的变化情况,浓硫酸溶于水放热分析实验现象,及试管中溶液的状态;
(3)据t℃时氯化钠的溶解度分析计算.
点评:据溶解度曲线可知某温度下物质的溶解度,溶解度曲线的交点表示该温度下两物质的溶解度相等,浓硫酸溶于水放热,然后据相关知识分析解答相应问题.
(2)氯化钠的溶解度随温度的升高而增大,但变化不大,硝酸钾的溶解度随温度的升高而增大,且变化较大,氢氧化钙的溶解度随温度的升高而减小,故将A、B、C三只试管放在盛有冷水的烧杯中,向烧杯中加入适量浓硫酸,浓硫酸溶于水使溶液温度升高,则A中硝酸钾的溶解度增大,固体会减少,食盐的主要成分是氯化钠,则B中氯化钠溶解度稍微变大,饱和食盐水变为不饱和,C中氢氧化钙的溶解度减小,有氢氧化钙固体析出,溶液变浑浊;
(3)观察图示:t℃时氯化钠的溶解度大约是37g,所以将40g食盐放入100g水中充分溶解,所得溶液中溶质的质量分数约为
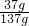 ×100%≈27%;
×100%≈27%;故答案为:(1)t°C时,硝酸钾和氯化钠的溶解度相同;
(2)A中固体减少,C中出现浑浊; 不饱和;
(3)27%.
分析:(1)溶解度曲线的交点表示该温度下两物质的溶解度相等;
(2)据氯化钠、硝酸钾、氢氧化钙的溶解度随温度的升高的变化情况,浓硫酸溶于水放热分析实验现象,及试管中溶液的状态;
(3)据t℃时氯化钠的溶解度分析计算.
点评:据溶解度曲线可知某温度下物质的溶解度,溶解度曲线的交点表示该温度下两物质的溶解度相等,浓硫酸溶于水放热,然后据相关知识分析解答相应问题.

练习册系列答案
相关题目