题目内容
【题目】向盛有50g稀硫酸的烧杯中加入20g黄铜(铜锌合金)样品粉末,恰好完全反应,此时烧杯内剩余物的质量为69.8g。请完成下列计算:
(1)恰好完全反应时,产生的气体的质量是______g。
(2)该黄铜样品粉末中金属锌的质量是______g。
(3)所使用的稀硫酸的溶质质量分数是多少______?(写出计算过程,结果精确到0.1%)
【答案】0.2 6.5 19.6%
【解析】
根据质量守恒定律可知,过程中质量的减少是因为生成了氢气,所以可以求算氢气的质量,根据氢气的质量和对应的化学方程式求算锌的质量和稀硫酸中溶质的质量分数。
解:根据质量守恒定律可得,生成的氢气的质量为50g+20g-69.8g=0.2g;
设锌的质量为x,稀硫酸中溶质的质量分数为y,
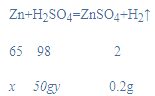
![]() x=6.5g,
x=6.5g,
![]() y=19.6%,
y=19.6%,
答:(1)恰好完全反应时,产生的气体的质量是 0.2g,
(2)该黄铜样品粉末中金属锌的质量是 6.5g,
(3)所使用的稀硫酸的溶质质量分数是19.6%。

练习册系列答案
相关题目