题目内容
【题目】根据下列实验装置图回答问题:
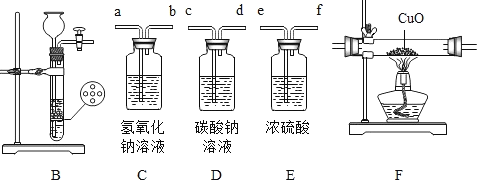
(1)写出a仪器、b仪器的名称:____、____。
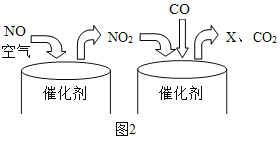
(2)实验室可用过氧化氢溶液和少量二氧化锰混合快速制取氧气,二氧化锰在此反应中起____作用,若利用该反应制取并收集一瓶干燥的氧气,应选择上列装置中的B、____和C。
(3)实验室制取CO2反应的化学方程式为____,实验结束后,从反应残留物中提取固体溶质时,按如下流程操作:
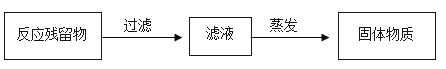
过滤所用的玻璃仪器除烧杯、玻璃棒外,还有____(填仪器名称),在蒸发过程中,当____时,停止加热,利用蒸发皿的余热使滤液蒸干。
(4)Cu2(OH)2CO3是碱式碳酸铜的化学式,它是一种绿色粉末,俗名铜绿,受热条件下会分解成三种氧化物,其受热分解的化学方程式为____。若用实验证明加热碱式碳酸铜有新物质生成,应将干燥的碱式碳酸铜放入___装置进行反应,观察到__,证明生成物之一为水。
【答案】铁架台 集气瓶 催化 F ![]() 漏斗 蒸发皿中出现较多量固体
漏斗 蒸发皿中出现较多量固体 ![]() A 试管口有小液滴形成
A 试管口有小液滴形成
【解析】
(1)a为固定装置的铁架台,b为收集气体的集气瓶;
(2)利用过氧化氢和二氧化锰制备氧气时,二氧化锰加速过氧化氢的分解,起到催化作用;过氧化氢溶液和二氧化锰制取氧气为固液反应物,反应条件则不需要加热,所以发生装置为B,制备干燥氧气不能用排水法收集,选择向上排空法收集,因此收集装置为C,过氧化氢溶液带有水蒸气,所以需要干燥,浓硫酸具有吸收性,且不与氧气反应,所以可以干燥生成的氧气,利用C收集干燥的氧气,所以还需要F,吸收水蒸气;
(3)实验室采用大理石与稀盐酸制备二氧化碳,大理石主要组分为碳酸钙,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,书写化学方程式注意配平及气体符号,所以化学方程式为![]() ;过滤除了利用烧杯盛取滤液,玻璃棒引流外,还需要漏斗进行过滤;蒸发时不得将液体蒸干,当蒸发皿中出现较多固体时,停止加热,利用余热将水分蒸干,得到固体;
;过滤除了利用烧杯盛取滤液,玻璃棒引流外,还需要漏斗进行过滤;蒸发时不得将液体蒸干,当蒸发皿中出现较多固体时,停止加热,利用余热将水分蒸干,得到固体;
(4)根据化学式可以得出三种氧化物为氧化铜、水和二氧化碳,所以分解的化学方程式为![]() ;碱式碳酸铜为固体,反应条件为加热,所以需要选择固体加热装置,所以为A,试管口向下倾斜,可以在试管口观察是否有液滴生成,判断生成物是否含有水。
;碱式碳酸铜为固体,反应条件为加热,所以需要选择固体加热装置,所以为A,试管口向下倾斜,可以在试管口观察是否有液滴生成,判断生成物是否含有水。

 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】Mg(OH)2是一种新型的阻燃剂,在温度达到380°C时吸收热量并分解产生水,同时生成的氧化镁附着于可燃物的表面阻止了进一步燃烧。
(1)Mg(OH)2 受热分解化学方程式是________________;工业常用氯化镁溶液与烧碱溶液制取Mg(OH)2,化学方程式是___________________。
(2)某同学用氨水在实验室模拟制取Mg(OH)2的过程:一定温度下,往含一定量氯化镁的溶液中加入适量氨水( 氨水易挥发),再经过滤、洗涤得到Mg(OH)2晶体。为探究获得较高Mg(OH)2晶体转化率条件,该同学进行如下对比实验,数据如下:
实验编号 | 氯化镁溶液溶质质量分数 | 反应温度/°C | Mg(OH)2转化率/% |
a | 10% | 30 | 27.06 |
b | 15% | 30 | 56.77 |
c | 15% | 40 | 69.64 |
d | 15% | 60 | 54.30 |
e | 20% | 60 | 50.60 |
①实验b和c的目的是______________________。
②由实验可知,能够得到最多Mg(OH)2的条件是溶质质量分数_______和温度__________°C。
③在氯化镁溶液溶质质量分数都是15%的情况下,60°C 时Mg(OH)2的转化率比40°C时低的原因是________________。
(3)根据燃烧的条件可知,Mg(OH)2能做阻燃剂的原因是________________(填编号)。
①清除可燃物 ②使温度 降低到着火点以下 ③隔绝空气
(4)氯化镁溶液通过循环利用,理论上转化率可以达到100%。若生产了2.9吨Mg(OH)2,理论上需要原料20%的氯化镁溶液_______________吨。
【题目】为了证明氢氧化钠和稀盐酸反应有新物质生成,兴趣小组的同学进行了下列实验:
(实验目的)证明氢氧化钠溶液与稀盐酸发生了反应且生成了新物质。
(实验原理)___________ (用化学方程式表示)。
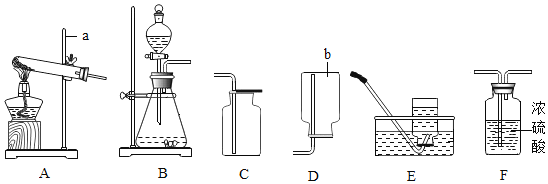
(药品仪器)
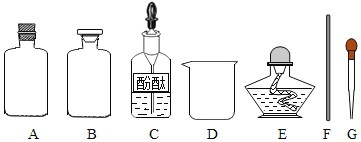
(实验步骤)
①取______(选填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色。
②用G_______(填仪器名称)向①所得的溶液中滴加稀盐酸,直至红色刚好消失。
③向②所得溶液中继续滴加稍过量稀盐酸,溶液保持无色。
④用F蘸取③所得溶液,在酒精灯上灼烧,有白色固体产生。
(思考拓展)
(1)步骤③的目的是:__________。
(2)进一步确认步骤④所得的白色固体不是氢氧化钠,不能选用的试剂有:_________。
ACuSO4溶液 BNa2CO3溶液 C无色酚酞试液 D(NH4)2SO4溶液
(3)已知酚酞试液在不同pH时的变色情况如下表。
pH | <8.2 | 8.2~10.0 | >10.0 |
颜色 | 无色 | 红色 | 无色 |
小文同学发现向某氢氧化钠溶液中滴加酚酞试液, 发现溶液瞬间变红但立即又变成无色,他接着逐滴加入稀盐酸,某一时刻溶液变红了,没有褪色,继续滴加稀盐酸,后褪至无色。小文认为该氢氧化钠溶液刚开始时滴加酚酞试液出现异常现象的原因,可能是氢氧化钠溶液浓度过大导致的,请你设计实验方案帮助他证明猜想:_________。