题目内容
【题目】控制化学反应的条件可以促进或抑制化学反应,更好地使化学反应为人类造福.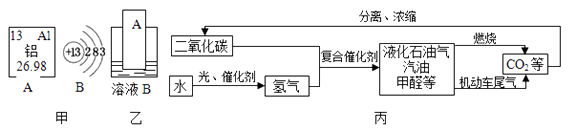
(1)元素周期表中铝元素的信息如图甲所示,其相对原子质量为 . 化学反应中该原子容易(填“得到”或“失去”)电子;
(2)铝制品在生活中因耐用而应用越来越广泛,主要原因是(用化学方程式表示);
(3)运载“嫦娥三号”的火箭外壳用到了钛合金,钛合金属于(填“混合物”或“纯净物”);
(4)要通过图乙实验得出铝和铜的金属活动性顺序,如果B是硫酸铜溶液,则金属A是(填化学式),如果A是铜,则溶液B中溶质的名称是;
(5)如图丙是科学家正在研究的二氧化碳循环利用技术:
①二氧化碳与氢气在催化剂、高温条件下,除生成甲醇(CH4O)外,还生成一种常温下为液态的化合物,写出反应的化学方程式;
②尿素[CO(NH2)2]对提高粮食产量具有重要的作用.人们控制条件可以使CO2和物质X发生反应:CO2+2X═CO(NH2)2+H2O,物质X的化学式为。
【答案】
(1)26.98,失去
(2)4Al+3O2= 2Al2O3
(3)混合物
(4)Al,硫酸铝(氯化铝或硝酸铜)
(5)CO2+3H2 ![]() CH4O+H2O,NH3
CH4O+H2O,NH3
【解析】解:(1)相对原子质量为:26.98;由于该原子最外层电子数为3,化学反应中易失去电子;(2)铝制品在生活中因耐用而应用越来越广泛,主要原因是:铝与空气中的氧气反应,生成氧化铝薄膜,阻止铝进一步被氧化。化学方程式为:4Al+3O2=2Al2O3;(3)钛合金属于混合物;(4)在金属活动顺序里,位于前面的金属能把位于后面的金属从它们的盐溶液里置换出来。如果B是硫酸铜溶液,则金属A是:Al;如果A是铜,则溶液B中溶质的名称是:硫酸铝(氯化铝或硝酸铜);(5)①反应的化学方程式:CO2+3H2 ![]() CH4O+H2O②根据质量守恒定律,化学反应前后原子的种类和数目不变,反应前C、O原子个数是1、2;反应后C、O、N、H原子个数是1、2、2、6,故物质M的化学式为NH3。
CH4O+H2O②根据质量守恒定律,化学反应前后原子的种类和数目不变,反应前C、O原子个数是1、2;反应后C、O、N、H原子个数是1、2、2、6,故物质M的化学式为NH3。
故答案为:26.98;失去;4Al+3O2= 2Al2O3;混合物;Al;硫酸铝(氯化铝或硝酸铜);CO2+3H2 ![]() CH4O+H2O;NH3。
CH4O+H2O;NH3。
在该图中,左上角表示原子序数,原子序数=质子数=核外电子数=核电荷数;当原子最外层电子数大于4时易得电子,小于4时易失电子;所有的合金都属于混合物。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案