题目内容
【题目】金属在生产生活中应用广泛。
(1)补齐下列金属制品与其性质的连线。
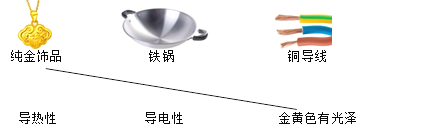
________________
(2)铜是人类认识并应用最早的金属之一。“湿法炼铜”是利用铁与硫酸铜溶液反应制取铜,该反应的化学方程式是______。
(3)工业上用赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁,该反应的化学方程式是______。
【答案】 铁锅连导热性 铜导线连导电性 Fe + CuSO4 === FeSO4 + Cu 3CO + Fe2O3![]() 3CO2 + 2Fe
3CO2 + 2Fe
【解析】(1)根据铁锅有导热性,铜导线有导电性解答;(2)根据铁和硫酸铜反应生成铜和硫酸亚铁解答;(3)根据一氧化碳在高温的条件下还原氧化铁,生成铁和二氧化碳解答。(1)铁锅有导热性,故铁锅连导热性;铜导线有导电性,故铜导线连导电性;(2)铁和硫酸铜反应生成铜和硫酸亚铁,反应的化学方程式为Fe+CuSO4=Cu+FeSO4;(3)一氧化碳在高温的条件下还原氧化铁,生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO高温2Fe+3CO2。

【题目】空气是我们赖以生存的宝贵资源。
(1)空气属于_____(填“纯净物”或“混合物”),其中能供给呼吸的物质是_____。
(2)下表为北京市某监测点监测到的空气质量。依据表格回答问题:

污染项目 | PM2.5 | PM10 | SO2 | CO | NO2 |
污染指数 | 69 | 95 | 9 | 0.8 | 42 |
①首要污染物是______;其中会形成酸雨的是______(填1种即可)。
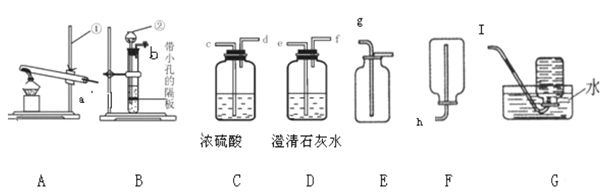
② 上图为一款新型环保车,可通过360 °旋转的“大炮筒”向四周喷水,从而缓解极端恶劣天气给人带来的不适。分析这款环保车喷水的作用是______。
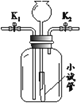
【题目】某化学兴趣小组利用下图装置进行实验。实验前K1、K2 均已关闭。
实验装置 | 【实验1】制取O2 | 【实验2】用NaOH溶液除去 O2中混有的CO2 |
| I.广口瓶中放入少量MnO2 II.打开K2,从长颈漏斗加入H2O2溶液至溢出小试管 | I.打开K1、K2,从长颈漏斗加入足量NaOH溶液至瓶中液面高于左侧导管口且低于小试管口 II. …… |
(1)连接仪器后,加水至长颈漏斗中形成液柱。一段时间后,液面高度保持不变,该现象说明______。
(2)实验1:制取O2的化学方程式是______。
(3)实验2:
①II中操作是:从______(填“左”或“右”)侧导气管通入混合气体。
②除去CO2 的反应如下,补全该反应的化学方程式:2NaOH + CO2 === Na2CO3 + ______
③实验过程中,当通入气体的流速突然变大时,小试管可以防止广口瓶中大量液体从长颈漏斗上口溢出,其原因是______。
【题目】对比、归纳是化学学习的重要方法,请补充完成下列实验报告。
【实验目的】探究物理变化和化学变化
【实验过程】
实验操作 | 实验现象、分析或结论 | |
实验一 | 步骤一:取少量硫酸铜晶体放在研钵内观察。 | 现象:晶体为蓝色 |
步骤二:用研杵将硫酸铜晶体研碎 | 现象:___________________。 | |
步骤三:在2支试管中分别放入少量研碎前、后的硫酸铜晶体,并进入少量水,振荡得到澄清的硫酸铜溶液 | 现象:研碎后的硫酸铜晶体溶解的更快。 分析:原因是_______________________。 | |
步骤四:向上述两支试管中各滴加少量氢氧化钠溶液 | 现象:2支试管中均有蓝色不溶物生成。 分析: (1)该反应的化学方程式是_________; (2)该对比实验得出的实验结论是_______。 | |
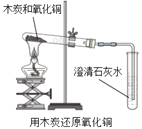
实验二 |
| 现象:有部分黑色粉末变红,澄清石灰水变浑浊。 分析: (1)粉末由黑色变成红色的过程中发生化学反应的化学方程式是___________; (2)上述现象说明木炭和氧化铜发生了化学变化。 |
【实验结论】有他物质生成的变化叫化学变化,没有其他物质生成的变化叫物理变化。