题目内容
【题目】通过实验现象和题给信息,按要求填空。为测定空气的成分按下图进行实验: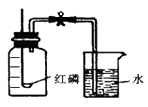
(1)将燃烧匙中过量的红磷点燃后放集气瓶中,此时能观察到的现象是 , 反应的化学方程式是:。
(2)此实验的结论是。
(3)此实验进入集气瓶的水超过第一个刻度线的原因是(答一条)
(4)已知:镁+氮气 点燃→氮化镁(固体) 根据上述反应,能否用镁来测定空气中氮气所占的体积分数?(填“能”或“不能”)
【答案】
(1)红磷燃烧,产生大量白烟,4P+5O2 ![]() 2P2O5
2P2O5
(2)O2约占空气总体积的五分之一
(3)弹簧夹未夹紧(或塞瓶塞时速度太慢)
(4)不能
【解析】(1)红磷燃烧产生大量白烟,放出热量,生成物是五氧化二磷,反应的化学方程式为:4P+5O2 ![]() 2P2O5; (2)反应后冷却打开止水夹,烧杯中的水会进入达到集气瓶体积的五分之一,故结论:O2约占空气总体积的五分之一;(3) 此实验进入集气瓶的水超过第一个刻度线,是因为实验过程中瓶内的气体排出的过多导致的,造成的原因可能是弹簧夹未夹紧或塞瓶塞时速度太慢; (4)镁在空气中燃烧即与氧气反应,又与氮气反应,整个装置会进满水,故不能镁测定空气中氮气所占的体积分数。
2P2O5; (2)反应后冷却打开止水夹,烧杯中的水会进入达到集气瓶体积的五分之一,故结论:O2约占空气总体积的五分之一;(3) 此实验进入集气瓶的水超过第一个刻度线,是因为实验过程中瓶内的气体排出的过多导致的,造成的原因可能是弹簧夹未夹紧或塞瓶塞时速度太慢; (4)镁在空气中燃烧即与氧气反应,又与氮气反应,整个装置会进满水,故不能镁测定空气中氮气所占的体积分数。
所以答案是:红磷燃烧,产生大量白烟、4P+5O2 ![]() 2P2O5、O2约占空气总体积的五分之一、弹簧夹未夹紧(或塞瓶塞时速度太慢)、不能。
2P2O5、O2约占空气总体积的五分之一、弹簧夹未夹紧(或塞瓶塞时速度太慢)、不能。
【考点精析】解答此题的关键在于理解空气的成分及各成分的体积分数的相关知识,掌握空气是混合物:O2约占1/5,可支持燃烧;N2约占4/5,不支持燃烧,也不能燃烧,难溶于水.

练习册系列答案
相关题目