题目内容
把6.4g铁粉投入到硫酸和硫酸铜的混合溶液中,反应中有气体产生,铁粉恰好完全反应.过滤得到的固体物质的质量与原来加入的铁粉质量相等.则产生氢气的质量为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
分析:因为铁粉恰好完全反应无剩余,所以过滤得到的固体就只有铜单质,分析题干可知过滤得到的铜为6.4g,那么根据铁和硫酸铜反应的化学方程式,由铜的质量可求出与硫酸铜反应的铁的质量,进而求出与硫酸反应的铁的质量,最后根据铁和硫酸反应的方程式求出生成氢气的质量.
解答:解:设与硫酸铜反应的铁的质量为x
Fe+CuSO4═FeSO4+Cu
56 64
x 6.4g
=
x=5.6g
那么与硫酸反应的铁的质量为:6.4g-5.6g=0.8g
设铁与稀硫酸反应后产生的氢气质量为y
Fe+H2SO4═FeSO4+H2↑
56 2
0.8g y
=
y=
g
故选B
Fe+CuSO4═FeSO4+Cu
56 64
x 6.4g
| 56 |
| 64 |
| x |
| 6.4g |
那么与硫酸反应的铁的质量为:6.4g-5.6g=0.8g
设铁与稀硫酸反应后产生的氢气质量为y
Fe+H2SO4═FeSO4+H2↑
56 2
0.8g y
| 56 |
| 2 |
| 0.8g |
| y |
| 1 |
| 35 |
故选B
点评:此题是根据化学方程式的简单计算,涉及的化学方程式有两个,做此题首先需正确写出这两个方程式,然后认真审题获得有利数据来解答此题.

练习册系列答案
相关题目
把6.4g铁粉投入到硫酸和硫酸铜的混合溶液中,反应中有气体产生,铁粉恰好完全反应。过滤得到的固体物质的质量与原来加入的铁粉质量相等。则产生氢气的质量为
| A.1/32 g | B.1/35 g | C.1/64 g | D.1/70 g |
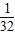 g
g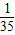 g
g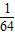 g
g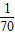 g
g