题目内容
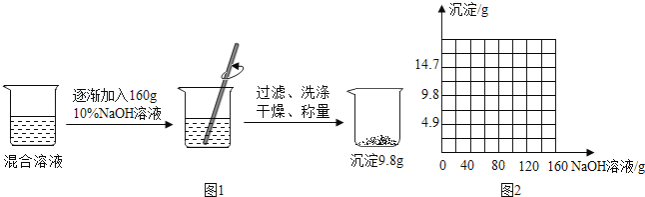
【题目】一个烧杯中盛有一定量盐酸和氯化铜的混合溶液,已知其中盐酸溶质的质量为3.65克,小明为了测定原混合溶液中氯化铜的质量如图1,进行下列实验.
(1)请根据NaOH的化学式计算氧元素和氢元素的质量之比为 ,NaOH的相对分子质量为 ;
(2)求原混合溶液中氯化铜的质量(写出计算过程);(CuCl2+2NaOH=Cu(OH)2↓+2NaCl)
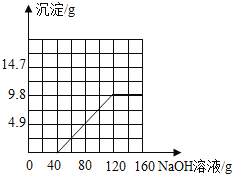
(3)请在图2中绘制生成沉淀质量与氢氧化钠溶液质量的关系图.(请用黑色签字笔作图)
【答案】(1)16:1;40;
(2)原混合溶液中氯化铜的质量为13.5g;
(3)
【解析】(1)NaOH中氧元素和氢元素的质量之比=16:1;NaOH的相对分子质量=23+16+1=40;故填:16:1;40;
(2)设原混合溶液中氯化铜的质量为x,氯化铜消耗氢氧化钠溶液的质量为y.
CuCl2 +2NaOH=Cu(OH)2↓+2NaCl
135 80 98
x y×10% 9.8g
![]()
x=13.5g
![]()
y=80g
答:原混合溶液中氯化铜的质量为13.5g;
(3)盐酸消耗的氢氧化钠溶液的质量为z.
HCl+NaOH=2NaCl+H2O
36.5 40
3.65g z×10%
![]()
z=40g
所以当恰好完全反应时消耗氢氧化钠溶液的质量=40g+80g=120g,生成沉淀的质量为9.8g.
生成沉淀质量与氢氧化钠溶液质量的关系图为:


练习册系列答案
相关题目
