题目内容
钙是人体必需的常量元素,每日必须摄入足够量的钙。目前市场上的补钙药剂很多,如图是某种品牌的补钙药品的部分说明书。请回答下列问题:

(1)CaCO3中钙元素的质量分数为________。
(2)若每片钙片的质量为1 g,则钙片中钙元素的质量分数为_______。
(3)如果按用量服用,通过服用此钙片,每天摄入钙元素的质量是多少?______
实验室部分装置如图所示,回答下列问题。
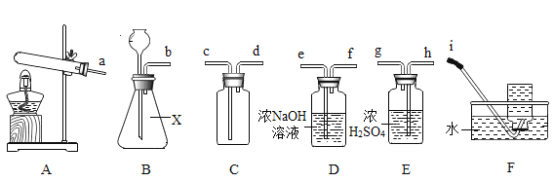
(1)实验室可用高锰酸钾在装置A中制氧气,其化学方程式为__。
(2)实验室用金属锌和稀盐酸反应制取H2,其化学方程式为____,为了得到纯净干燥的H2,请从中选择合适的装置,并按照顺序组装整套装置B→__→____ →C.用装置C收集H2时,气体从___管口通入装置C。
(3)实验室制取二氧化碳的化学方程式为____,制得的二氧化碳气体中含有氯化氢,可将 气体通入饱和碳酸氢钠溶液除去其中的氯化氢,其原理用方程式表示为____。欲收集较纯净的二氧化碳可采用的收集装置是___(填写装置序号)。
(4)某兴趣小组对KClO3分解分解制取氧气的反应催化剂进行研究,在相同的加热条件下,获得如下数据。
编号 | KClO3质量/g | 催化剂 | 催化剂质量/g | 收集50 mL O2所需时间/s |
实验1 | 5 | — | — | 176 |
实验2 | 5 | MnO2 | 0.5 | 49 |
实验3 | 5 | Fe2O3 | 0.5 | 68 |
实验4 | 5 | KCl | 0.5 | 135 |
①表中所列3种催化剂中催化效果最佳的是______。
②由实验1和实验4可知,KCl____(填“有”或“无”)催化作用。
③为准确直观比较分解速率的快慢,除测定收集一定体积的O2所需时间,还可以测定________。
某兴趣小组探究氢氧化钠的性质时进行了如图所示的实验。观察到试管A中出现了白色沉淀,试管B中溶液变红色,可是过一会儿红色却消失。小组同学重新进行实验,但现象相同。为此同学进行了如下探究,请你参与:
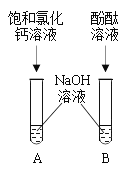
探究一:探究A试管现象产生的原因
[提出问题]A试管中产生白色沉淀的原因是什么?
[猜想]猜想一:氢氧化钠溶液中含有碳酸钠(猜想的依据是___________);猜想二:可能氢氧化钠溶液浓度较大。
[设计实验]
操作 | 现象 | 结论 |
_____________ | _____________ | 猜想一不正确,猜想二正确 |
写出A试管中发生反应的化学方程式_____________________。
探究二:探究B试管中溶液褪色的原因
[提出问题]是什么原因导致滴有酚酞的NaOH溶液由红色褪为无色?
[猜想]甲同学:可能与O2有关;乙同学;可能与______________大小有关。
[设计实验]两位同学分别设计实验验证自己的猜想:
(1)甲同学设计了如下实验,请你填写下表。
实验步骤 | 实验目的 | 现象 | 结论 |
① 将NaOH溶液加热煮沸 | __________ | 溶液先变红,后又变成无色 | 自己的猜想不正确 |
② 向冷却后的溶液中滴入酚酞,并滴一些植物油在其上方 | __________ |
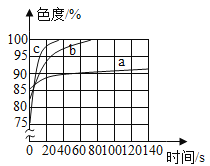
(2)乙同学使用了色度传感器测溶液的颜色:他在a、b、c三个比色皿中分别加入等量5%、10%、20%的NaOH溶液然后各滴加2滴酚酞试液。溶液颜色的变化曲线如图[说明:溶液无色时色度值(透过率)为100%]。乙同学实验的结论是________________。



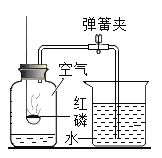 测定空气中氧气含量 B.
测定空气中氧气含量 B.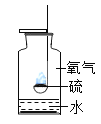 硫在氧气中燃烧
硫在氧气中燃烧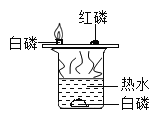 探究燃烧条件的实验 D.
探究燃烧条件的实验 D.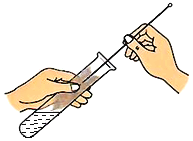 试管的洗涤
试管的洗涤