题目内容
 如图为某药厂生产的盖中盖高钙片标签,为检验其含钙量是否与标签相符,取一片高钙片于试管中,滴加50克足量的稀盐酸(假定其他物质不与盐酸反应),充分反应后剩余物质的质量为52.06克.
如图为某药厂生产的盖中盖高钙片标签,为检验其含钙量是否与标签相符,取一片高钙片于试管中,滴加50克足量的稀盐酸(假定其他物质不与盐酸反应),充分反应后剩余物质的质量为52.06克.求:
(1)一片高钙片中碳酸钙的质量;
(2)该药厂生产的钙片是否合格?
考点:根据化学反应方程式的计算,化合物中某元素的质量计算
专题:有关化学方程式的计算
分析:(1)根据碳酸钙的化学式,可计算碳酸钙中钙元素的质量分数;由标签标注每片中钙元素的含量,利用碳酸钙中钙元素质量分数,计算每片含碳酸钙质量;
(2)利用质量守恒定律,由反应前后质量差求出反应放出二氧化碳的质量,根据反应的化学方程式,计算所取钙片中碳酸钙质量,然后求出钙片中碳酸钙的含量,与标签中含量进行对比,判断标注是否属实.
(2)利用质量守恒定律,由反应前后质量差求出反应放出二氧化碳的质量,根据反应的化学方程式,计算所取钙片中碳酸钙质量,然后求出钙片中碳酸钙的含量,与标签中含量进行对比,判断标注是否属实.
解答:解:
(1)碳酸钙CaCO3中钙元素的质量分数=
×100%=40%,每片高钙片中钙元素的质量为:2.5g×20%=0.5g,
一片高钙片中碳酸钙的质量为:
=1.25g
(2)根据质量守恒定律可知.生成二氧化碳的质量为:2.5g+50g-52.06g=0.44g
设参加反应的碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 0.44g
=
x=1g
钙片中碳酸钙的含量=1g<1.25g,钙片中碳酸钙的含量标注不属实
答案:
(1)一片高钙片中碳酸钙的质量1.25g
(2)该药厂生产的钙片不合格
(1)碳酸钙CaCO3中钙元素的质量分数=
| 40 |
| 100 |
一片高钙片中碳酸钙的质量为:
| 0.5g |
| 40% |
(2)根据质量守恒定律可知.生成二氧化碳的质量为:2.5g+50g-52.06g=0.44g
设参加反应的碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 0.44g
| 100 |
| 44 |
| x |
| 0.44g |
x=1g
钙片中碳酸钙的含量=1g<1.25g,钙片中碳酸钙的含量标注不属实
答案:
(1)一片高钙片中碳酸钙的质量1.25g
(2)该药厂生产的钙片不合格
点评:利用质量守恒定律求出反应放出二氧化碳的质量,是进行后面计算的基础,体现出运用知识分析问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
空气中含有的氧化物是( )
| A、氧气 | B、水蒸气 |
| C、稀有气体 | D、氧化铝 |
下列符号“2”表示的含义正确的是( )
| A、O2中的“2”表示2个氧原子 |
| B、2N中“2”表示2个氮元素 |
| C、H2O中的“2”表示水分子中含有2个氢原子 |
| D、2SO3中的“2”表示2个二氧化硫分子 |
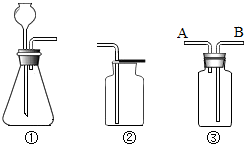 实验室里用①与②组合制取一种气体,其反应的化学方程式为
实验室里用①与②组合制取一种气体,其反应的化学方程式为