题目内容
【题目】某工厂产生的烧渣(主要含FeO、Fe2O3,还有一定量的SiO2)可用于制备七水合硫酸亚铁晶体(FeSO47H2O),其工艺流程如下:

查阅资料:SiO2不溶于水,也不与稀硫酸反应。
(1)“浸取”步骤中,FeO、Fe2O3和稀硫酸发生反应的化学方程式分别为FeO+H2SO4=FeSO4+H2O、_____。
(2)为提高“浸取”步骤的反应速率,可采取的具体措施有_____(写1条,不考虑“搅拌”和“使用催化剂”)。
(3)“过滤”操作需要使用的玻璃仪器有烧杯、玻璃棒和_____,“过滤”后得到的滤液中的溶质有_____(填化学式)。
(4)“还原”步骤的目的是将Fe3+转化为Fe2+,试剂X可用SO2或Fe。
①若试剂X是SO2,转化原理为SO2+Fe2 (SO4)3+2Y═2FeSO4+2H2SO4,则Y的化学式是_____。
②若试剂X是Fe,转化原理为Fe+Fe2 (SO4)3═3FeSO4.测得“还原”后溶液的pH明显增大,其原因是_____。
【答案】Fe2O3+3H2SO4═Fe2(SO4)3+3H2O 。把烧渣研碎漏斗 ,FeSO4、Fe2(SO4)3、H2SO4 (填化学式)。H2O 。铁消耗过量的硫酸,导致溶液酸性减弱 。
【解析】
化学反应遵循质量守恒定律,即反应前后元素种类、原子个数、原子质量都不变;稀硫酸和氧化亚铁反应生成硫酸亚铁和水,和氧化铁反应生成硫酸铁和水;反应物接触越充分、温度越高,反应速率越快;铁和稀硫酸反应生成硫酸亚铁和氢气。
(1)氧化铁与硫酸反应生成硫酸铁和水,SiO2不溶于水,也不与稀硫酸反应。“浸取”步骤中,FeO、Fe2O3和稀硫酸发生反应的化学方程式分别为FeO+H2SO4=FeSO4+H2O、Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(2)反应物接触越充分、温度越高,反应速率越快。为提高“浸取”步骤的反应速率,可采取的具体措施有将烧渣研碎、升高温度等;
(3)“过滤”操作需要使用的玻璃仪器有烧杯、玻璃棒和漏斗,根据第(1)题的分析可知,“过滤”后得到的滤液中的溶质有反应生成的硫酸亚铁、硫酸铁和过量的硫酸化学式分别为FeSO4、Fe2(SO4)3、H2SO4;
(4)①由化学方程式可知,反应前后,硫原子都是4个,铁原子都是2个,反应后氢原子是4个,根据质量守恒定律可知,氢原子反应前应该是4个,包含在2Y中,反应后的氧原子是16个,反应前应该是16个,其中2个包含在2Y中,反应的化学方程式为:SO2+Fe2 (SO4)3+2H2O═2FeSO4+2H2SO4,则Y的化学式是H2O;
②pH增大,溶液的酸性减弱。测得“还原”后溶液的pH明显增大,其原因是铁消耗过量的硫酸,导致溶液酸性减弱。

 阅读快车系列答案
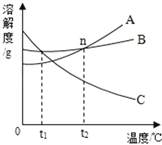
阅读快车系列答案【题目】根据下表回答问题:
温度(℃) | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 100℃ | |
溶解度 (g/100g 水) | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 246 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 39.8 | |
① 20℃时,50 克水中最多能溶解 NaCl______ g。
② 将硝酸钾的不饱和溶液转化为饱和溶液的方法________。(任写一种方法)若硝酸钾溶液中混有少量氯化钠,可通过______的方法提纯。
③ 硝酸钾和氯化钠溶解度相同的温度范围为______。(填编号)
I. 0℃-10℃ II. 10℃-20℃ III. 20℃-30℃ IV. 30℃-40℃
④ 30℃时,在两个各盛有 100 克水的烧杯中,分别加入相同质量的硝酸钾和氯化钠,充分溶解后,其结果如图所示。

I. 两烧杯中的溶质质量分数大小关系为 A________ B。(填“>”“<”或“=”)
II. 加入的甲物质是________。
III. 对 B 中乙溶液的分析,正确的是______。
a. 加水,溶质质量分数一定变小
b. 一定是该温度下的不饱和溶液
c. 溶解的固体质量一定大于 36.3g,小于 45.8g d. 降温至 10℃,一定有晶体析出
【题目】“分解”与“化合”是两种研究物质组成的方法。
研究问题 | 探究水的元素组成 | 探究氧化汞的元素组成 |
研究方法 | 水的分解 | 汞与氧气的化合 |
搜集证据 |
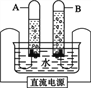
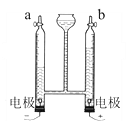
用燃着的木条检验a端气体,气体燃烧发出________色火焰,发生反应的化学方程式为________;用带火星的木条检验b端气体,观察到________。 | 汞与氧气化合的微观过程示意图
请将上图中反应后缺少的微粒补画完整________。 |
结论 | 水是由________元素组成的。 | 氧化汞是由氧、汞元素组成的。 |