题目内容
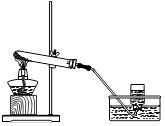
【题目】如图所示,往水电解器中加入96g蒸馏水和2g Na2SO4(Na2SO4不参与反应,仅起增加水的导电性的作用)组成的混合物,然后进行电解,当负极得到2g气体时,停止实验(所需相对原子质量:H﹣1、O﹣16).计算: 
(1)停止实验时,电解消耗水的质量是多少?
(2)停止实验后,剩余溶液中Na2SO4的质量分数是多少?
【答案】
(1)解:负极得到的是氢气,也就是氢气的质量为2g
设生成2g氢气消耗的水的质量为x
2H2O | 2H2↑+O2↑ |
36 | 4 |
x | 2g |
![]() =
= ![]()
x=18g
由于过程中硫酸钠仅起增加水的导电性的作用,相当于是本反应的催化剂,其质量保持不变.
(2)解:剩余溶液中Na2SO4的质量分数为 ![]() ×100%=2.5%
×100%=2.5%
【解析】由于过程中硫酸钠仅起增加水的导电性的作用,相当于是本反应的催化剂,其质量保持不变.根据电解水正氧负氢,氢二氧一可知,负极为氢气也就是得到2g氢气,根据氢气的质量和对应的化学方程式求算消耗的水的质量,进而求算所得溶液中硫酸钠的质量分数.
【考点精析】本题主要考查了根据化学反应方程式的计算的相关知识点,需要掌握各物质间质量比=系数×相对分子质量之比才能正确解答此题.

练习册系列答案
相关题目