题目内容
【题目】某同学利用如图装置探究铁与氧化铁化合的生成物成分。
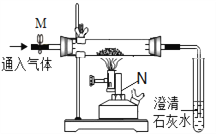
【认识仪器】由仪器N可知该反应的条件是_____________。
【查阅资料】铁的氧化物中只有Fe3O4能被磁铁吸引。
某些铁的氧化物加热时能与氧气反应。
【提出猜想】猜想①是FeO;
猜想②是Fe3O4;
猜想③是FeO和Fe3O4混合物。
【实验步骤】
①连接组装仪器,检查装置的气密性,方法是:关闭弹簧夹M,_________________________________________________________。
②称取16.0g氧化铁粉末与质量为m的铁粉,均匀混合后,放入玻璃管。
③通入CO2,当观察到明显现象时,夹上弹簧夹M,开始加热玻璃管。
④当固体全部呈黑色后,停止加热,______________________________________。将玻璃管中黑色粉末倒在滤纸上,取样,滴加稀盐酸,无气泡产生,用磁铁吸引,粉末被部分吸引。
【实验结论】猜想_________成立。所加铁粉质量m的范围是_________________。
【问题讨论】实验中澄清石灰水的主要作用是______________________________。
【答案】 高温 将导管末端放入水中,双手紧贴玻璃管外壁(微微加热玻璃管),导管口有气泡冒出,松手(停止加热)后,导管口形成一段稳定水柱 继续通二氧化碳气体直到玻璃管冷却 ③ 1.4g~5.6g 判断玻璃管中空气是否已排尽
【解析】【认识仪器】仪器N是酒精喷灯,可知该反应需要高温;
【实验步骤】①检查装置的气密性时,可以关闭弹簧夹M,将导管末端放入水中,双手紧贴玻璃管外壁(微微加热玻璃管),导管口有气泡冒出,松手(停止加热)后,导管口形成一段稳定水柱,说明气密性良好。
④实验结束前,为防止灼热的生成物与空气接触发生反应,应继续通入原来的气体,直到生成物冷却为止;
【实验结论】生成的黑色粉末能被磁铁完全吸引,说明铁与氧化铁化合的生成物的成分为FeO和Fe3O4;
假设铁与氧化铁完全反应生成氧化亚铁,需要铁的质量为a
Fe2O3+ Fe![]() 3FeO
3FeO
160 56
16.0g a
![]() ;
;
a= 5.6g
假设产物只有四氧化三铁,需要的铁的质量为b
4Fe2O3+ Fe ![]() 3Fe3O4
3Fe3O4
640 56
16.0g b
![]()
b=1.4g
若黑色固体不能被磁铁全部吸引,且滴加稀盐酸,无气泡产生,说明剩余固体中含有氧化亚铁,并且没有铁单质;所以所加铁粉的质量范围是1.4g~5.6g;
【问题讨论】上述探究实验中使用CO2可以起到排除空气,作保护气,防止铁粉被氧化的作用;试管中的澄清的石灰水变浑浊;判断玻璃管中空气是否已排尽。

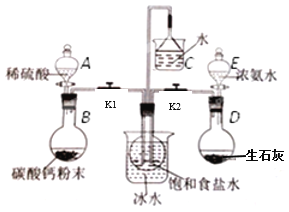
【题目】草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂。某小组用废镍催化剂(成分为Fe2O3、Ni、Fe、SiO2等)制备草酸镍晶体的部分实验流程如下:
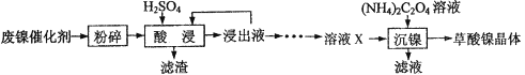
已知:①Ni能和稀H2SO4反应。
②相关金属离子生成氢氧化物沉淀的pH如下表:
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Ni2+ | 6.7 | 9.5 |
③H2O2能将Fe2+氧化为Fe3+
(1)废镍催化剂“粉碎”的目的是______。
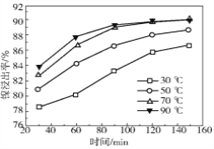
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图,“酸浸”的适宜温度与时间分别为 _______(填字母)。
A.30℃、30min B.90℃、150min C.70℃、120min D.90℃、120min
(3)“酸浸”中发生的复分解反应方程式为________。
(4)“浸出液”得到“溶液x”过程中,加入试剂先后顺序是_____(填字母)。
A.先加H2O2溶液,再加NaOH溶液 B.先加NaOH溶液,再加H2O2溶液
加NaOH溶液调节pH_____(填范围),充分反应后得到滤渣的操作是______,该操作中所用到的玻璃仪器有玻璃棒、烧杯和_________。
(5)将“沉镍”工序:①主要过程为:蒸发浓缩、_____ 、过滤,所得固体用75%乙醇洗涤、110℃下烘干,得草酸镍晶体。
②用75%乙醇洗涤的目的是洗去杂质、___________;
③烘干温度不超过110℃的原因是______。
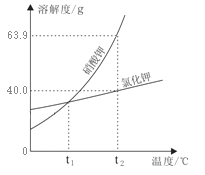
【题目】下表是氯化钠、硝酸钾在不同温度时的溶解度。据此判断:下列说法不正确的是
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
硝酸钾 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
A. 氯化钠和硝酸钾的溶解度曲线在20℃~30℃温度范围内会相交
B. 在20℃时, 向68g饱和氯化钠溶液中加入32g水,此时溶液中溶质的质量分数为18%
C. 从含有少量氯化钠的饱和硝酸钾溶液中得到较多的硝酸钾晶体,可采用冷却热饱和溶液使其结晶的方法
D. 分别将20℃时一定质量的饱和氯化钠溶液、饱和硝酸钾溶液升温至40℃,此时硝酸钾溶液中溶质的质量分数大于氯化钠溶液