题目内容
某同学按图1装置对质量守恒定律进行实验探究,已知碳酸钠(Na2CO3)粉末与盐酸(HCl)反应,产生二氧化碳气体、水和氯化钠.
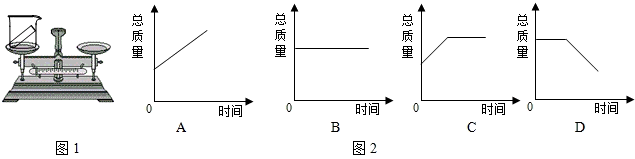
(1)此反应的化学方程式为________;观察到反应后天平不平衡,该反应________(填“遵守”或“不遵守”)质量守恒定律,不平衡的原因是________; 实验的改进方法是________.
(2)图2,横坐标代表反应时间,纵坐标代表物质总质量,则能正确表示改进后容器中所盛的物质反应前后总质量变化的是________.
解:(1)碳酸钠(Na2CO3)粉末与盐酸(HCl)反应,产生二氧化碳气体、水和氯化钠,反应的化学方程式是Na2CO3+2HCl=2NaCl+H2O+CO2↑;实验在敞口的容器中进行,生成的二氧化碳气体逸出,没有收集称量,所以,反应前后质量不相等;可以这样改进:①将烧杯改用锥形瓶,并在瓶口系一个气球,②将烧杯换成锥形瓶,瓶口用塞子塞住,并减少药品的量,最好是少量.
故答案为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;遵守;实验在敞口的容器中进行,生成的二氧化碳气体逸出,没有收集称量,所以反应前后质量不相等;将烧杯改用锥形瓶,并在瓶口系一个气球;
(2)碳酸钠(Na2CO3)粉末与盐酸(HCl)反应,产生二氧化碳气体、水和氯化钠,由于反应在密闭容器中进行,因此容器中所盛的物质的总质量不变.
故选B.
分析:(1)题中探究的是碳酸钠和盐酸反应前后是否平衡,因为碳酸钠与盐酸发生的是化学变化,故无论结果如何,都是遵守质量守恒定律的,之所以天平不平衡的原因是反应中生成了气体的缘故,所以要想天平平衡,就必须要在密闭容器中进行;
(2)由于反应在密闭容器中进行,因此容器中所盛的物质的总质量不变.
点评:本题是关于质量守恒定律的最基础的题型,只要考虑到反应所处的环境,即能想到反应装置的问题.
故答案为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;遵守;实验在敞口的容器中进行,生成的二氧化碳气体逸出,没有收集称量,所以反应前后质量不相等;将烧杯改用锥形瓶,并在瓶口系一个气球;
(2)碳酸钠(Na2CO3)粉末与盐酸(HCl)反应,产生二氧化碳气体、水和氯化钠,由于反应在密闭容器中进行,因此容器中所盛的物质的总质量不变.
故选B.
分析:(1)题中探究的是碳酸钠和盐酸反应前后是否平衡,因为碳酸钠与盐酸发生的是化学变化,故无论结果如何,都是遵守质量守恒定律的,之所以天平不平衡的原因是反应中生成了气体的缘故,所以要想天平平衡,就必须要在密闭容器中进行;
(2)由于反应在密闭容器中进行,因此容器中所盛的物质的总质量不变.
点评:本题是关于质量守恒定律的最基础的题型,只要考虑到反应所处的环境,即能想到反应装置的问题.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
 ;c、不超过试管容积的
;c、不超过试管容积的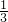 ;d、1ml-2ml四种.对于上述①~⑥操作,正确的液体(或水)的用量应是
;d、1ml-2ml四种.对于上述①~⑥操作,正确的液体(或水)的用量应是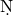 H4Cl________K
H4Cl________K 4CO2+2R+6H2O.则R的化学式为
4CO2+2R+6H2O.则R的化学式为