题目内容
【题目】某厂排出的废液中含Zn(NO3)2和AgNO3 , 为了从中回收金属银和硝酸锌,设计了以下实验步骤: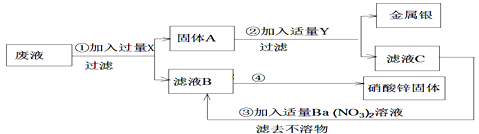
(1)写出X、Y的化学式:X , Y ;
(2)写出固体A的成分的化学式:;写出滤液B中溶质的化学式:;④中涉及的操作。
(3)写出③的化学方程式:
【答案】
(1) Zn, H2SO4
(2)Zn和Ag,Zn(NO3)2,蒸发结晶
(3)ZnSO4 + Ba(NO3)2= BaSO4↓+ Zn(NO3)2
【解析】(1)我们向废液中加入过量的锌,让锌与硝酸银反应Zn+AgNO3═Ag+Zn(NO3)2然后过滤,得到固体A为(Zn、Ag)和液体B为 Zn(NO3)2溶液.为了把固体A中的银和锌分开,我们可以加入过量的Y即稀硫酸溶液.故X、Y的化学式分别为:X:Zn,Y:H2SO4;
(2)固体A中加入过量Y即稀硫酸溶液后,其中锌与稀硫酸反应会生成硫酸锌,故滤液C为硫酸锌溶液.故固体A和滤液B、C中主要成分的化学式分别为:A:Ag,Zn;B:Zn(NO3)2;溶液,要想得到硝酸锌固体,我们可以对溶液进行加热蒸发.故④操作:先过滤,再将滤液蒸发结晶。
(3)③的化学方程式:ZnSO4 + Ba(NO3)2= BaSO4↓+ Zn(NO3)2
所以答案是:
(1)Zn,H2SO4;
(2)Zn和Ag,Zn(NO3)2,ZnSO4.蒸发结晶;
(3)ZnSO4+Ba(NO3)2=BaSO4↓+Zn(NO3)2
【考点精析】根据题目的已知条件,利用金属材料的选择依据和金属活动性顺序及其应用的相关知识可以得到问题的答案,需要掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属;在金属活动性顺序里:1、金属的位置越靠前,它的活动性就越强2、位于氢前面的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸)3、位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来.(除K、Ca、Na).

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案