题目内容
如图是表示M、N两种物质饱和溶液的溶质质量分数随温度变化的曲线.现分别向50g M、80g N固体中各加入150g水,并加热至完全溶解,同时各蒸发掉50g水,冷却至t℃,下列分析正确的是
- A.只有N析出晶体
- B.只有M析出晶体
- C.M、N均有晶体析出
- D.M、N两种溶液的溶质质量分数相等
A
分析:根据题意,加水150克,加热溶解,同时蒸发掉50克水,冷却至t℃,这一系列变化后,相当于在t℃时用150g-50g=100g水分别去溶解50克M和80克N固体,判断此时的溶解情况;因此可根据饱和溶液的溶质质量分数随温度变化的曲线,算出T℃两物质的溶解度,然后判断此时100g水所能溶解两种物质的最大值,从而对所做的判断进行评价.
解答:首先计算t℃时M、N两物质的溶解度:根据饱和溶液的溶质质量分数随温度变化的曲线,t℃时M、N两物质的饱和溶液的溶质质量分数相等都为40%,根据饱和溶液的溶质质量分数与溶解度的关系:溶质质量分数=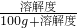 ×100%,可知此时两物质的溶解度相等,设为x,则有
×100%,可知此时两物质的溶解度相等,设为x,则有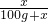 ×100%=40%,解得x≈67g;
×100%=40%,解得x≈67g;
然后根据溶解度判断两物质在t℃时的溶解情况:t℃时M、N两物质的溶解度为67g,即此时100g水最多溶解M、N物质的质量都为67g,所以,加入的50gM可以全部溶解且形成不饱和溶液,加入的80gN不能全部溶解而成为饱和溶液;故A正确,BC错误;
综合以上分析,当降温到t℃时固体M不会析出,而固体N物质析出80g-67g=13g;由于此时M溶液不饱和溶液而N溶液为饱和溶液,因此两溶液的溶质质量分数也不相等;故D错误;
故选A.
点评:解题时一定要注意:所给的曲线不是溶解度曲线,而是饱和溶液的溶质质量分数随温度变化的曲线,并使用饱和溶液中溶质质量分数与溶解度的关系进行分析解答.
分析:根据题意,加水150克,加热溶解,同时蒸发掉50克水,冷却至t℃,这一系列变化后,相当于在t℃时用150g-50g=100g水分别去溶解50克M和80克N固体,判断此时的溶解情况;因此可根据饱和溶液的溶质质量分数随温度变化的曲线,算出T℃两物质的溶解度,然后判断此时100g水所能溶解两种物质的最大值,从而对所做的判断进行评价.
解答:首先计算t℃时M、N两物质的溶解度:根据饱和溶液的溶质质量分数随温度变化的曲线,t℃时M、N两物质的饱和溶液的溶质质量分数相等都为40%,根据饱和溶液的溶质质量分数与溶解度的关系:溶质质量分数=
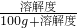 ×100%,可知此时两物质的溶解度相等,设为x,则有
×100%,可知此时两物质的溶解度相等,设为x,则有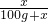 ×100%=40%,解得x≈67g;
×100%=40%,解得x≈67g;然后根据溶解度判断两物质在t℃时的溶解情况:t℃时M、N两物质的溶解度为67g,即此时100g水最多溶解M、N物质的质量都为67g,所以,加入的50gM可以全部溶解且形成不饱和溶液,加入的80gN不能全部溶解而成为饱和溶液;故A正确,BC错误;
综合以上分析,当降温到t℃时固体M不会析出,而固体N物质析出80g-67g=13g;由于此时M溶液不饱和溶液而N溶液为饱和溶液,因此两溶液的溶质质量分数也不相等;故D错误;
故选A.
点评:解题时一定要注意:所给的曲线不是溶解度曲线,而是饱和溶液的溶质质量分数随温度变化的曲线,并使用饱和溶液中溶质质量分数与溶解度的关系进行分析解答.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目